

| 选项 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 还原性:I->Br+>Cl- |
| C | 开始铜粉不溶解,溶液呈无色,后有气体放出,溶液呈蓝色 | 氧化性:NaNO3>H2SO4>Cu2+ |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.原电池中活泼金属做负极;
B.生成的Br2中含有Cl2;
C.硫酸与铜不反应,不能证明氧化性H2SO4>Cu2+;
D.比较非金属性应为最高价氧化物的水化物的酸性.
解答 解:A.左烧杯中铁表面有气泡,说明活动性Al>Fe,右边烧杯中铜表面有气泡,说明活动性Fe>Cu,则活动性为Al>Fe>Cu,故A正确;
B.因生成的Br2中含有Cl2,则不能证明还原性I->Br+,故B错误;
C.硫酸与铜不反应,不能证明氧化性H2SO4>Cu2+,故C错误;
D.比较非金属性应为最高价氧化物的水化物的酸性,不能用盐酸,并且盐酸易挥发,生成的二氧化碳中混有HCl,不能证明非金属性C>Si,故D错误.
故选A.
点评 本题考查实验方案的评价,题目难度中等,易错点是能正确把握比较物质性质的角度.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
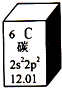 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的相对原子质量为12.01 | |
| D. | 该元素没有同位素,所有原子的中子数均为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
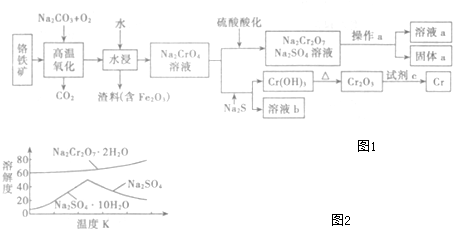
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④⑤⑥ | C. | ④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
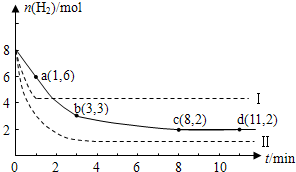
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
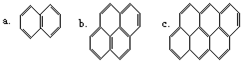 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )| A. | 100% | B. | 56% | C. | 97.3% | D. | 93.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
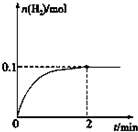 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| C. | 煤经过气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5分散在空气中可能形成胶体或浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com