
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Mg2+、HCO3- | B. | K+、NH4+、NO3-、SO42- | ||
| C. | Al3+、K+、NO3-、HCO3- | D. | K+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60的摩尔质量是720 | |
| B. | 金刚石、石墨和C60互为同位素 | |
| C. | 因石墨具有导电性,可用石墨炸弹破坏输电线、电厂设备 | |
| D. | 在点燃的条件下,碳可以还原氧化镁生成镁和二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.3% | B. | 40% | C. | 60% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
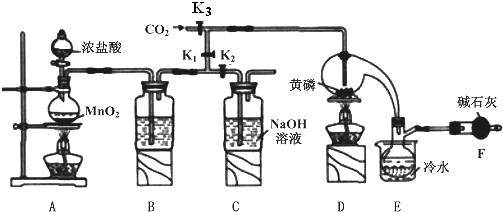
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
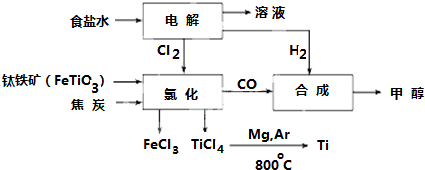
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1molH2(g)和1mol I2(g)总能量小于2mol HI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量为2akJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com