
| 10-6+10-4 |
| 2 |
| Kw |
| c(H+) |
| 10-6+10-4 |
| 2 |
| Kw |
| c(H+) |
| 10-14 |
| 5.05×10-5 |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、①②④ | B、②③④ |
| C、①③④ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| NaOH/H2O |
| H+ |
| Fe/HCl |

查看答案和解析>>
科目:高中化学 来源: 题型:
| Ca(OH)2悬浊液 |
| 加热 |
| HBr |
| 一定条件 |
| NaOH水溶液 |
| 酸化 |
| 浓H2SO4 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下:
利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol?L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g?L-1 | ρ1 | ρ2 | |
| 平衡常数/L2?mol-2 | K甲 | K乙 | K丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
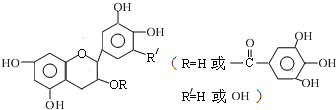
| A、常温下,儿茶素不溶于水,也不溶于有机溶剂 |
| B、儿茶素一定不能发生水解反应 |
| C、1mol儿茶素最少可与5mol NaOH反应 |
| D、儿茶素能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.54g |
| B、3.34g |
| C、2.57g |
| D、2.34g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com