
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加铜片和浓硫酸,加热 | 有无色气体产生,遇空气变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有不溶于稀硝酸的白色沉淀生成 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
分析 无色溶液中,有色离子不存在,氢氧化铝是两性氧化物,能溶于强碱中,白色且不溶于硝酸的白色沉淀是氯化银或者是硫酸钡,在酸性环境下,能和氢离子反应的离子不共存,根据离子反应的现象以及离子共存的知识加以分析.因是一无色透明溶液,则不含有Fe2+,
由①取少量该溶液,加几滴甲基橙,溶液显红色,说明溶液显示酸性,所以HCO3-不存在;
由②取少量该溶液加热浓缩,加Cu片和浓硫酸,加热有无色气体产生,气体(NO)遇空气可以变成红棕色(二氧化氮),说明溶液中含有NO3-,则一定不含有I-;
由③取少量该溶液,加Ba(NO3)2溶液,有白色沉淀生成,则含有SO42-;
由④取③中的上层清夜,加AgNO3,有稳定的白色沉淀生成,且不溶于稀硝酸,则含有Cl--,所以原离子中含有Cl-;
由⑤取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则含有铝离子、镁离子.
解答 解:无色溶液中,有色离子不存在,氢氧化铝是两性氧化物,能溶于强碱中,白色且不溶于硝酸的白色沉淀是氯化银或者是硫酸钡,在酸性环境下,能和氢离子反应的离子不共存,根据离子反应的现象以及离子共存的知识加以分析.因是一无色透明溶液,则不含有Fe2+,
由①取少量该溶液,加几滴甲基橙,溶液显红色,说明溶液显示酸性,所以HCO3-不存在;
由②取少量该溶液加热浓缩,加Cu片和浓硫酸,加热有无色气体产生,气体(NO)遇空气可以变成红棕色(二氧化氮),说明溶液中含有NO3-,则一定不含有I-;
由③取少量该溶液,加Ba(NO3)2溶液,有白色沉淀生成,则含有SO42-;
由④取③中的上层清夜,加AgNO3,有稳定的白色沉淀生成,且不溶于稀硝酸,则含有Cl--,所以原离子中含有Cl-;
由⑤取少量该溶液,加入NaOH溶液有白色沉淀生成,当NaOH过量时,沉淀部分溶解,则含有铝离子、镁离子.
(1)综上可知,溶液中一定存在的离子是NO3-、SO42- Mg2+、Al3+、Cl-,溶液中肯定不存在的离子是故答案为:NO3-、SO42- Mg2+、Al3+、Cl-;I-、Ba2+、Fe2+、HCO3-;
(2)溶液中的K+在检验过程中不能判断,需要进一步实验验证,可以利用焰色反应隔着钴玻璃观察为紫色火焰;
故答案为:钾离;焰色反应;
(3)取少量该溶液,加入NaOH溶液,会发生反应有:H++OH-=H2O,Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,氢氧化铝能和氢氧化钠反应,而氢氧化镁则不能,反应的实质是Al(OH)3+OH-═2H2O+AlO2-或Al(OH)3+OH-=[Al(OH)4]-,故答案为:H++OH-=H2O;Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=[Al(OH)4]-.
点评 本题考查离子的共存问题,明确题中信息的挖掘和应用是解答的关键,并熟悉离子不能共存的常见的原因即可解答.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C(碳) | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$ Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化硅陶瓷 耐高温 | B. | 氧化锆陶瓷 韧性和耐磨性 | ||
| C. | 钛酸钡陶瓷 导电性 | D. | 氧化铝陶瓷 透光性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同素异形体 | B. | 16O与18O核外电子排布不同 | ||
| C. | 麦芽糖与蔗糖互为同分异构体 | D. | CH3CH3与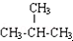 互为同系物 互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com