
【题目】(l)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是 。
②四种金属活动性由强到弱的顺序是 。
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向 (填“正极”或“负极’) 。负极的电极反应式是 , 标准状况下生成 L气体。
(3)断开1 mol H一H键、1 mol N一H键、1 mol N≡N 键分别需要吸收能量为436KJ、391KJ、946KJ,求:H2与N2反应生成0.5 molNH3填(“吸收”或“放出”)能量 KJ。
(4)原子序数大于4的主族元素A和B的离子分别为Am+和Bn-,已知它们的核外电子排布相同,据此推断:
① A和B所属周期数之差为(填具体数字) 。
② A和B的核电荷数之差为(用含m或n的式子表示) 。
③ B和A的族序数之差为 .
【答案】(1)①Cu2++2e-=Cu ②D>A>B>C
(2)正极 Zn—2e—=Zn2+2.24
(3)放出 23(4)①1 ②m+n ③8-m-n
【解析】试题分析:(1)①乙装置中C的质量不断增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应式是Cu2++2e-=Cu;
②甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活泼性由强到弱的顺序是D>A>B>C。
(2)锌的金属性强于铜,则由Zn一Cu一硫酸溶液组成的原电池中锌是负极,失去电子,负极电极反应式为Zn—2e—=Zn2+;铜是正极,溶液中的氢离子放电产生去,即正极反应式为2H++2e-=H2↑,工作一段时间后锌片的质量减少了6.5g,则消耗锌的物质的量是6.5g÷65g/mol=0.1mol,转移0.2mol电子,因此产生氢气是0.1mol,在标准状况下的体积是0.1mol×22.4L/mol=2.24L;原电池中阳离子向正极移动,因此溶液中的H+移向正极。
(3)焓变即反应热=反应物中总键能-生成物中总键能,则生成2mol氨气的反应热=3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92kJ/mol,因此H2与N2反应生成0.5 molNH3放出的热量是92kJ/mol×0.5mol/2=23kJ。
(4)①Am+和Bn-它们的核外电子排布相同,故A原子比B原子多一个电子层,故二者的周期数之差为1;
②Am+和Bn-它们的核外电子排布相同,由核电荷数=原子序数=核外电子数可知ZA-m=ZB+n,则ZA-ZB=m+n;③B的族序数为8-n,A的族序数为m,B和A的族序数之差为8-n-m。


科目:高中化学 来源: 题型:
【题目】计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是__________。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因:______________________________。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液中c(H+)约为__________mol/L。(精确计算,且己知![]() )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是____________________。
②在KHC2O4溶液中,各粒子浓度关系正确的是__________。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O42-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮锌镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放人6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,得质量为m2 。下列说法正确的是
A.设锌镀层厚度为h,锌的密度为ρ,则![]()
B.锌电极的电极反应式为2H2O+2e-==H2↑+2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁片,冲洗后用酒精灯加热烘干,铁片可能部分被氧化,导致实验结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) ![]() H2(g)+I2(g)△H<0
H2(g)+I2(g)△H<0
(1)该反应平衡常数的表达式为K=______________,则H2(g)+I2(g) ![]() 2HI(g)平衡常数的表达式为K1=_____________(用K表示)。
2HI(g)平衡常数的表达式为K1=_____________(用K表示)。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为________,HI的分解率为________。
(3)能判断该反应达到平衡状态的依据是________
A.容器中压强不变
B.混合气体中c(HI)不变
C.c(I2)=c(H2)
D.v(HI)正=v(H2)逆
(4)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的浓度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向_________(填“正向”或“逆向”,下同)进行,若升高温度,反应向_________进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容器可变的密闭容器中,反应N2(g)+3H2(g)![]() 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______(选填“增大”、“减小”,下同),v逆______,平衡向______方向移动(选填“正反应”、“逆反应”)。
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为______反应(选填“吸热”、“放热”)。
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______(填写编号)。

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______(选填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】我国成功研制出丁苯酞,标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平。合成丁苯酞(J)的一种路线如下
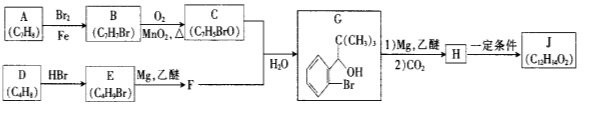
已知:①

②E的核磁共振氢谱只有一组峰;
③J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)对E的系统命名
(2)由B生成C反应类型为
(3)C中官能团名称为 ,C分子中最多有 个原子共平面。(已知甲醛中所有原子共面)
(4)由H生成J的化学方程式为 (写明反应条件)。
(5)![]() 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中:
①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。
满足上述条件X的同分异构体共有 种(不考虑超出中学范围的顺反异构和手性异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 。
(6)参考题中信息和所学知识,写出由甲醛和化合物A合成2一苯基乙醇(![]() )的路线流程图(其它试剂任选)。合成路线流程图表达方法例如下:
)的路线流程图(其它试剂任选)。合成路线流程图表达方法例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为甲同学设计的制取并检验C2H4性质的实验装置图。请回答有关问题:
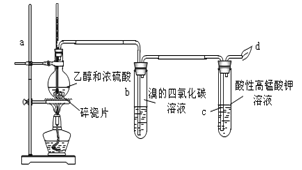
(1)写出上述制乙烯的反应的化学方程式: ,
(2)加入几片碎瓷片的目的是 ,
(3)加热时,使混合液温度迅速升高到170℃,是为了 ,
(4)实验过程观察到的现象为:
①Br2的四氯化碳溶液由 色变 ,
②酸性KMnO4溶液 。
(5)乙同学认为甲同学设计的实验如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有 气体也能使酸性KMnO4溶液褪色。写出此气体使酸性KMnO4溶液褪色的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰胺-66(尼龙-66)常用于生产帐篷、渔网、弹力丝袜等织物。可以利用以下路线来合成。D的核磁共振氢谱有两个峰。
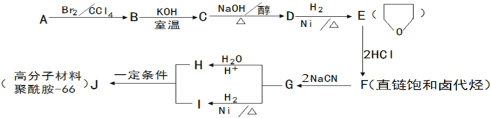
已知: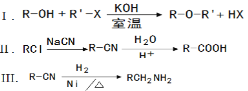
(1)1molA和1molH2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数约为65%,则X的分子式为 ,A分子中所含官能团的名称是 。
(2)B→C的反应类型是_________________。
(3)C→D的化学方程式为_______________________________________。
(4)F与氢氧化钠的乙醇溶液共热,得到有机产物Y
①Y的名称是_____________________。
②Y在一定条件下可以发生加聚反应得到以顺式结构为主的顺式聚合物,该顺式聚合物的结构简式为_____________________________。
(5)H和I反应生成J(聚酰胺-66)的化学反应方程式为_________________________。
为检验F中的官能团,所用试剂包括NaOH水溶液及 。
(6)同时满足下列条件的H的同分异构体有多种。写出其中一种同分异构体的结构简式(核磁共振氢谱有三个峰,面积比为4:4:2)________________________。
①只含一种官能团 ②1mol该物质与足量银氨溶液反应,生成4molAg
(7)已知: ![]()
![]()
写出以苯酚和HCHO为原料制备![]() 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着能源危机的加剧,我国也在大力推广新一代乙醇燃料,广西是我国甘蔗产量主产区之一,乙醇可以从甘蔗中提炼加工出来,乙醇除用作燃料外,还可以用它合成其他有机物。下面是以乙醇为起始原料的转化关系,请回答相关问题。
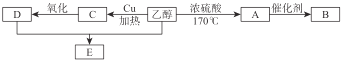
①B在日常生活中常用来作食品包装袋,但往往会带来环境问题。
写出A→B的化学方程式: 。
②写出乙醇→A的化学方程式: 。
③写出乙醇→C的化学方程式: 。
④写出E的方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com