
| A. | 反应物和生成物都是非极性分子 | |
| B. | 0.5molHCHO 含有1molσ键 | |
| C. | HCHO、CO2分子中中心原子杂化类型相 | |
| D. | 液态水中只存在一种作用力同 |
分析 A.该反应中,反应物和生成物中都存在极性分子和非极性分子;
B.单键中含有1个σ键,双键中含有1个σ键和1个π键;
C.生成物中都属于极性键,不存在非极性共价键;
D.液态水中存在分子间作用力、氢键和共价键.
解答 解:A.反应物中甲醛为极性分子、氧气为非极性分子,产物中二氧化碳为非极性分子、水为极性分子,故A错误;
B.单键中含有1个σ键,双键中含有1个σ键和1个π键,则甲醛中含有3个σ键,所以0.5molHCHO 含有1.5molσ键,故B错误;
C.HCHO、CO2分子中C原子的价层电子对数为2,其杂化类型相为sp杂化,故C正确;
D.液态水中存在分子间作用力、氢键和共价键,即液态水中存在多种作用力,故D错误,
故选C.
点评 本题考查化学键、分子的极性以及杂化类型的判断,该题基础性强,题目难度不大,有利于调动学生的学习兴趣,激发学生的学习积极性.


科目:高中化学 来源: 题型:选择题
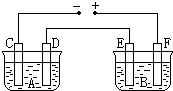 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A. | 质量增加6.4 g | B. | 质量增加12.8 g | C. | 质量减少6.4 g | D. | 质量减少12.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 【有机化学基础】
【有机化学基础】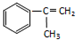 出发来合成M,路线如下:
出发来合成M,路线如下: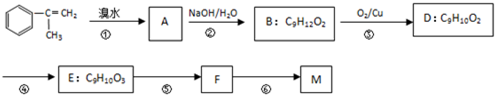
 .
. .
.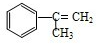 +Br2→
+Br2→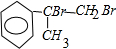 ;
;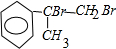 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$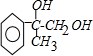 +2NaBr;
+2NaBr; +CH3OH $→_{△}^{浓H_{2}SO_{4}}$
+CH3OH $→_{△}^{浓H_{2}SO_{4}}$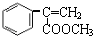 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
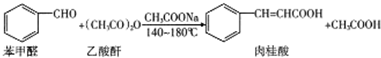
| 名称 | 分子量 | 相对密度 | 熔点 | 沸点 | 溶解度 |
| 苯甲醛 | 106 | 1.04 | -26 | 179.62 | 微溶于水,可混溶于乙醇、乙醚、苯 |
| 乙酸酐 | 102 | 1.080 | -73.1 | 138.6 | 溶于乙醚,易水解形成乙酸. |
| 肉桂酸 | 148 | 1.247 | 135 | 300 | 微溶于水,可以溶于苯、丙酮、乙醚、乙醇等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3:0.12 mol•L-1 | B. | H2O:0.09 mol•L-1 | ||
| C. | NO:0.03 mol•L-1 | D. | O2:0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
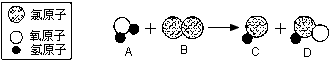
| A. | A物质属于氧化物 | |
| B. | D物质中氯元素的化合价为+1价 | |
| C. | 反应物和生成物均属于化合物 | |
| D. | 反应前后元素的种类和原子个数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com