
| 实验 编号 |
HA物质的量 | NaOH物质的量 | 混合溶液 |
| 浓度(mol?L-1) | 浓度(mol?L-1) | 的pH | |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
| c(H3O+)c(OH-) |
| c(H2O) |
| c(H3O+)c(O2-) |
| c(OH-) |
| ||
| 1L |
| c(H3O+).c(OH-) |
| c(H2O) |
| c(H3O+)c(O2-) |
| c(OH-) |
| ||
| 1L |
| c(H3O+).c(OH-) |
| c(H2O) |
| 10-14 |
| 55.6 |
| c(H3O+)c(O2-) |
| c(OH-) |


科目:高中化学 来源: 题型:
| A、22.4L甲烷中含有C-H键的数目为4NA |
| B、46g NO2和N2O4的混合气体中含有原子总数为3NA |
| C、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、Na2O2与足量H2O反应,共生成0.1mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色 |
| B、鉴别乙烷和乙炔可将二者分别通入酸性高锰酸钾溶液中 |
| C、苯能使溴水褪色是因为二者反应生成了溴苯 |
| D、工业上制备氯乙烯可用乙炔在一定条件下与氯化氢发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
B、 实验室制乙炔并验证其性质 |
C、 实验室中分馏石油 |
D、 分离碘酒中的碘和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气分子是极性分子而甲烷是非极性分子 |
| B、NH3分子中有一对未成键的弧对电子,它对成键电子的排斥作用较强 |
| C、NH3为分子中N原子形成3个杂化轨道,CH4中C原子形成4个杂化轨道 |
| D、两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:
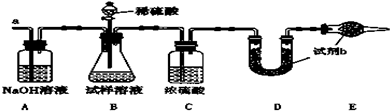
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com