
【题目】单质和化合物的主要区别在于它是否由( )
A.同种物质组成B.同种元素组成C.同种分子组成D.同种原子构成
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列对能源的看法不合理的是( )
A. 风能是人类通过风车等工具获取的能源,但属于一次能源
B. 生物质能是一种可再生能源,有广泛的应用前景
C. 太阳能、氢能、核能、地热能都属于新能源
D. 化石燃料与人类生活密切相关,要多开采,多使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A. 绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B. 五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C. 三聚氰胺分子结构如图所示 ,分子式是C3H6N6
,分子式是C3H6N6
D. 氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 短周期元素是指前4周期元素 B. 元素的非金属性越强,其含氧酸的酸性越强
C. 元素周期表中共有18列、16个族 D. 周期表中第四周期含有8种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |

回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2 ↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号);H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(2)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4-+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
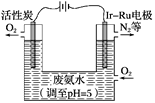
①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)________(填“>”“<”或“=”)c(NO3-)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为:______________________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,下列说法不正确的是( )

A. 装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B. 甲、乙装置中的能量变化均为化学能转化为电能
C. 装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D. 装置乙中负极的电极反应式:Zn-2e-===Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:

(1)化合物C中含氧官能团的名称为________、________。
(2)D→E的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(4)化合物B的分子式为C10H14O,写出B的结构简式:________________。
(5)已知: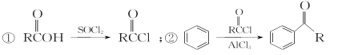 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com