
将m g含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1 mol/L的2L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是
A.(m-16)g B.(m+16)g C.(m-32)g D.16 g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
下列实验装置(部分固定装置略去)和有关叙述正确的是
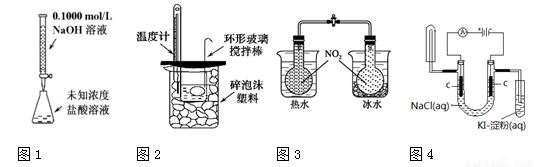
A.图1可以进行酸碱中和滴定实验
B.图2可以进行中和热的测定实验
C.图3可验证温度对化学平衡的影响
D.图4可电解食盐水并检验通电后的部分产物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高一上期中化学试卷(解析版) 题型:选择题
下列反应既是离子反应又是氧化还原反应的是
A.BaCl2溶液中滴入稀H2SO4 B.盐酸和氧化铁
C.氢气还原氧化铜 D.铁片放入CuSO4溶液中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上12月月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.钠和冷水反应: Na+2H2O=Na++2OH?+H2↑
B.金属铝溶于氢氧化钠溶液: Al+2OH?=AlO2?+H2?
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2?
D.铜和硝酸银溶液反应: Cu + 2Ag+ = 2Ag + Cu2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川阆中中学校高一上第二次段考化学试卷(解析版) 题型:选择题
下列反应的离子方程式中,书写正确的是
A.实验室用大理石跟稀盐酸制取二氧化碳
B.氯气与水反应 Cl2 + H2O = 2H+ + Cl- + ClO-
C.氧化铝跟氢氧化钠溶液反应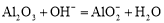
D.金属钠跟水反应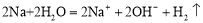
查看答案和解析>>
科目:高中化学 来源:2016届天津市高三上12月学业调研化学试卷(解析版) 题型:实验题
关于电解池应用的规律提炼题组
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
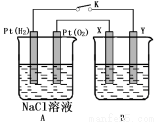
(1)通O2的Pt电极为电池 极(填电极名称),其电极反应式为 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为 ,电解质溶液为 。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在 电极(填“X”或“Y”)周围有固体沉积,该电极的电极反应式为 。
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)。恢复到常温下,B电池溶液的pH= ,要使该溶液恢复到原来的状态,需加入 (填物质并注明物质的量)。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为 。
(6)若X、Y均是Pt,电解质溶液为Na2SO4溶液,通电一段时间后,在阴极上逸出c mol气体,同时有N g Na2SO4•10H2O 晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为 。
(学法题)通过以上题目,请总结书写电极反应式的关键 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期末理综化学试卷(解析版) 题型:填空题
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。请回答以下问题:
(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’);
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 ;
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。

(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+ AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。

①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应是 。
②该电池工作时,当外电路转移4NA e— 时生成 mol I2。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。已知:As2O3与NaOH溶液反应生成AsO33-,则As2O5与NaOH溶液反应的离子方程式是 ;
②上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。( 已知2Na2S2O3+I2=Na2S4O6+2NaI ,MAs =75)试样中As2O5的质量是 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016年海南省高一上第三次月考化学试卷(解析版) 题型:选择题
相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为
A.1:1 B.1:6 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源:2015-2016年江西省高二上12月月考化学试卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com