
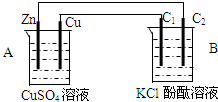
 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题分析 (1)有外加电源的是电解池,没有外加电源的是原电池或者根据原电池和电解池的构成条件来回答;
(2)原电池中活泼金属锌是负极,金属铜是正极,正极上是电解质里的阳离子得电子的还原反应;
(3)石墨棒C2和原电池的负极相连,氢离子得电子发生还原反应,石墨棒C1和原电池的正极相连,是阳极,该电极上氯离子失电子发生氧化反应,据此回答;
(4)根据电子守恒定律结合电极反应式进行计算回答.
解答 解:(1)装置A符合原电池的构成条件:两个活泼性不同的电极,属于原电池,Zn失电子族负极,装置B符合电解池的构成条件,属于电解池;
故答案为:原电池;电解池;
(2)A中金属锌是负极,金属铜是正极,正极反应是:Cu2++2e-→Cu,故答案为:正;Cu2++2e-→Cu;
(3)石墨棒C2和原电池的负极相连,是阴极,石墨棒C1和原电池的正极相连,是阳极,该电极上氯离子失电子,发生氧化反应:2Cl--2e-→Cl2↑,在阴极上,氢离子放电产生氢气,2H++2e-→H2↑,所以氢离子浓度减小而氢氧根浓度增大,碱性增强,使酚酞变红,
故答案为:阳;电极上有气泡产生,无色溶液变红色;
(4)C2极发生的电极反应为:2H++2e-→H2↑,析出224mL(即0.01mol)气体(标准状态)时,转移电子数是0.02mol,所以锌极转移电子也为0.02mol,根据电极反应:Zn-2e-→Zn2+,消耗金属锌0.01mol,质量是0.01mol×65g/mol=0.65g,故答案为:0.65.
点评 本题考查了原电池和电解池原理的应用,把握原电池和电解池的工作原理以及电子守恒原理,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
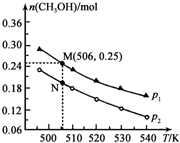 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
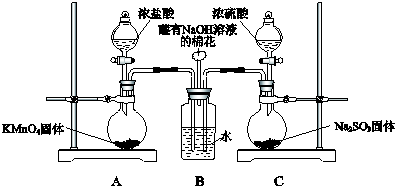
 某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中加水,$\frac{c(HC{O}_{3}^{-})•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| B. | 加入Na2CO3固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构 | |
| D. | 蔗糖是还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com