
【选修5-有机化学基础】(15分)
已知:稀碱液中卤苯难水解。芳香族化合物C的分子式为C9H9OCl。C分子中有二条侧链,苯环上一氯代物只有二种,其核磁共振氢谱图中有五个吸收峰,吸收峰的面积之比为1∶2∶2∶2∶2。在一定条件下,由物质C可发生如图所示的转化:
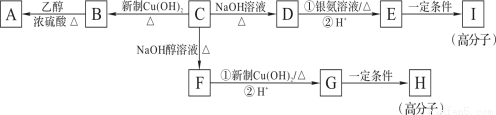
(1)C→F的反应类型是_______;H的结构简式是________;
(2)C分子中的官能团名称 ,最少有_____个碳原子共面;
(3)写出下列化学方程式:D与银氨溶液反应_________;E→I________;
(4)D的一种同系物W分子式为C8H8O2。则符合下列条件的W的同分异构体的结构简式 。
条件:①属于芳香族化合物 ②遇FeCl3溶液不变紫色 ③1 mol W可与含2 mol NaOH的溶液反应
(1)消去反应(1分); (2分) ;
(2分) ;
(2)8 (2分);氯原子 醛基(2分,各1分);
(3)
n

 +(n-1)H2O (2分)
+(n-1)H2O (2分)
(4) 或
或 (写出4种即可)(4分,每个1分)
(写出4种即可)(4分,每个1分)
(其他正确答案参照给分)
【解析】
试题分析:根据题给信息知,芳香族化合物C的分子式为C9H9OCl.C分子中有二条侧链,苯环上一氯代物只有二种,其核磁共振氢谱图中有五个吸收峰,吸收峰的面积之比为1:2:2:2:2,可知C的结构简式为 ,由转化关系可反应条件可知D为
,由转化关系可反应条件可知D为 ,E为
,E为 ,I为
,I为 ,F为
,F为 ,G为
,G为 ,H为
,H为 ,B为
,B为 ,A为
,A为 。(1)根据上述分析及题给转化关系知,C→F的为卤代烃的消去反应,反应类型是消去反应;H的结构简式是见解析;(2)C分子中的官能团名称氯原子、醛基,最少有8个碳原子共面;(3)D与银氨溶液反应醛基被氧化为羧基,E→I生成聚酯类高分子化合物,相关化学方程式见答案;(4)D的一种同系物W分子式为C8H8O2。①属于芳香族化合物②遇FeCl3溶液不变紫色,不含酚羟基;③1 mol W可与含2 mol NaOH的溶液,含有酯基,且水解生成羧基和酚羟基;应为乙酸苯酚酯、甲酸苯酚酯(含有甲基,有邻、间、对3种),共4种,结构简式见答案。
。(1)根据上述分析及题给转化关系知,C→F的为卤代烃的消去反应,反应类型是消去反应;H的结构简式是见解析;(2)C分子中的官能团名称氯原子、醛基,最少有8个碳原子共面;(3)D与银氨溶液反应醛基被氧化为羧基,E→I生成聚酯类高分子化合物,相关化学方程式见答案;(4)D的一种同系物W分子式为C8H8O2。①属于芳香族化合物②遇FeCl3溶液不变紫色,不含酚羟基;③1 mol W可与含2 mol NaOH的溶液,含有酯基,且水解生成羧基和酚羟基;应为乙酸苯酚酯、甲酸苯酚酯(含有甲基,有邻、间、对3种),共4种,结构简式见答案。
考点:考查有机合成和有机综合推断,涉及反应类型判断,结构简式、化学方程式、同分异构体的书写。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS)
B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大
C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体
D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数。下列叙述正确的是
A.1mol甲醇中含有C-H键的数目为4NA
B.标准状况下,2.24L已烷含有分子的数目为0.1NA
C.12克金刚石中含有的共价键数目为2NA
D.1 mol 甲基所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
A.H2O2的分解反应为放热反应
B.FeCl3是H2O2分解反应的催化剂
C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多
D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,不能达到实验目的的是
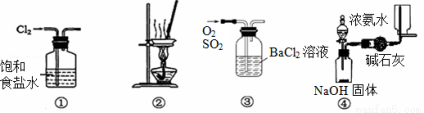
A.用装置①除去Cl2中含有的少量HCl
B.用装置②从KCl溶液中获得KCl晶体
C.用装置③除去O2中混有的一定量SO2
D.用装置④在实验室制取并收集氨气
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:推断题
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。

查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加盐酸生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K为 。
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
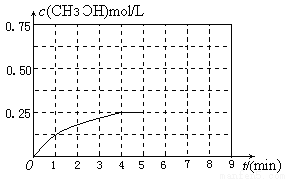
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)= 0.2 mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,正确的是

A.加NaOH,HA电离平衡常数增大
B.通入HCl,溶液中阴离子浓度之和减小
C.溶液中水的电离程度a>b>c
D.b点溶液中,c(HA)<c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com