
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����ش��������⣺
��1��д��COȼ�յ��Ȼ�ѧ����ʽ_____ ________��
��2��д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ_____________��
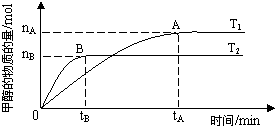
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T1��T2������300�棩��
���¶����߸÷�Ӧ��ƽ�ⳣ�� ������С�����䣩
��B������H2��ʾ�÷�Ӧ�Ļ�ѧ��Ӧ������ mol��L-1��min-1
��4����ֱ���Լ״�Ϊȼ�ϵĵ���У��������ҺΪ���ԣ��ܷ�ӦΪ��CH3OH+3/2O2+2OH-==CO32-+3H2O�������ķ�ӦʽΪ ��
��(1)2 CO(g) +O2(g) = 2 CO2(g) ��H=-566KJ��mol-1
(2) CH3OH(l)+ O2(g)=CO(g)+2H2O(l) ��H=-443.5kJ��mol-1
(3) ��С 3n(B)/[2��t(B)] (4) CH3OH-6e-+8OH-==CO32-+6H2O
����:�����ۺϿ����˻�ѧ��Ӧԭ�������֪ʶ��
��2���ɸ�˹������⣺
2 CO(g) + O2(g) = 2 CO2(g) ��H=-566KJ��mol-1 ��
CH3OH(l)+3/2 O2(g)=CO2(g)+2 H2O(l) ��H=-726.5kJ��mol-1 ��
����-��/2��֪�� CH3OH(l)+O2(g)=CO(g)+2 H2O(l) ��H=-443.5kJ��mol-1
��3����Ӧ����ʽ��CO2��3O2=CH3OH��H2O
��ͼ���֪����T2�¶��·�Ӧ�ȴﵽƽ�⣬���״���������٣�������ƽ�����ƣ�����Ӧ�Ƿ��ȷ�Ӧ��ƽ�ⳣ����С��
���ݷ�Ӧ���ʵĹ�ʽ��֪���ԣ��״���=n(B)/[2��t(B)]�����ԣ�������=3n(B)/[2��t(B)]
(4)ȼ�ϵ�����ܷ�ӦΪ��CH3OH+3/2O2+2OH-==CO32-+3H2O��
�����ķ�ӦʽΪ��CH3OH-6e-+8OH-==CO32-+6H2O
�����ķ�ӦʽΪ��O2��2H2O��4e��=4OH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2011?��������ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺
��2011?��������ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| nA |
| tA |
| a |
| 2 |
| a |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| n(H2) |
| n(CH3OH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ̼�ǻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ�
̼�ǻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com