
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4分子中N-N键角为109°28′ | |
| C. | N4分子中存在非极性键 | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
分析 A.化合物是由不同种元素组成的纯净物,单质是由同种元素组成的纯净物;
B.分子不是正四面体结构;
C.根据N4分子中存在氮氮键,属于非极性键;
D.根据化学键断裂要吸收热量,形成化学键要放出热量,根据题中数据计算出1molN4转变成N2放出的热量.
解答 解:A.N4由N组成,是一种单质,故A错误;
B.分子不是正四面体结构,所以N4分子中N-N键角不是109°28′,故B错误;
C.N4分子中存在氮氮键,属于非极性键,故C正确;
D.1molN4气体中含有0.6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误;
故选C.
点评 本题考查较为综合,涉及物质的组成和分类以及反应热的计算等问题,题目难度不大,注意基础知识的把握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳元素能够形成不同的单质,如C60、C70、金刚石等等.
碳元素能够形成不同的单质,如C60、C70、金刚石等等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
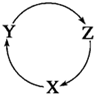 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( )| X | Y | Z | |
| A | Fe | FeCl3 | FeCl2 |
| B | NH3 | NO | NO2 |
| C | Na | NaOH | Na2CO3 |
| D | S | SO3 | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$mol/(L•min) | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 三个容器中反应的平衡常数均为K=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL、1mol•L-1的AlCl3溶液中,含Al3+的数目为0.1NA | |
| B. | 46g乙醇中所含共价键的数目为8NA | |
| C. | 1mol氧气与足量金属钠反应,氧气一定得到4NA个电子 | |
| D. | 100mL、18.4mol/L的硫酸与足量铜反应,生成二氧化硫的分子数0.92NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于N | |
| B. | 断开X、Y中的化学键吸收的能量大于形成M、N中化学键放出的能量 | |
| C. | X、Y的总能量一定高于M、N的总能量 | |
| D. | 因该反应是放热反应,故不加热一定可以反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com