



 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:不详 题型:单选题

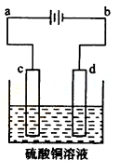
| A.a为正极、b为负极 |
| B.c为阳极、d为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放电时储氢合金作正极 |
| B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+ |
| C.充电时阳极周围c(OH-)减小 |
| D.充电时储氢合金作负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
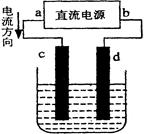
| A.b为正极、a为负极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: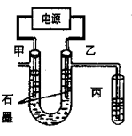
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化铜溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com