
分析 (1)钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
(3)在空气中加热FeCl3•6H2O,生成的是Fe(OH)Cl2,升高温度促进水解,所以得不到氯化铁,可以采用抑制水解的方法制取氯化铁;
(4)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;
(5)控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2Fe3++Fe=3Fe2+;
(2)根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,则溶液pH=-lg1.0×10-2=2,
故答案为:2;
(3)若在空气中加热FeCl3•6H2O,生成的是Fe(OH)Cl2,根据反应物、生成物及反应条件知,该反应的化学方程式:FeCl3•6H2O=Fe(OH)Cl2+HCl↑+5H2O,升高温度促进水解,所以得不到氯化铁,为抑制水解,需要在干燥的HCl气流中加热FeCl3•6H2O来得到FeCl3,
故答案为:FeCl3•6H2O=Fe(OH)Cl2+HCl↑+5H2O;在干燥的HCl气流中抑制FeCl3水解,且带走FeCl3•6H2O受热产生的水气,所以能得到无水氯化铁;
(4)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3;
故答案为:K1>K2>K3;
(5)控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;
点评 本题考查盐的水解原理、电荷守恒的计算以及平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
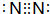 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
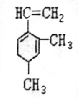 己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.
己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.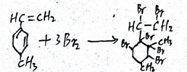 ;
;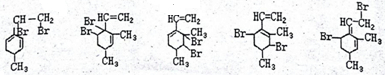 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| B. | 由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| C. | 中性溶液中:Fe3+、K+、Al3+、SO42- | |
| D. | 在0.1 mol•L-1Na2CO3溶液中:A1O2-、Na+、NO3-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
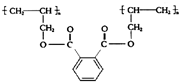 则合成该高聚物的单体的正确组合是( )
则合成该高聚物的单体的正确组合是( )| A. | ①② | B. | ③④ | C. | ①③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Fe2O3、Al2O3混合物中的Fe2O3加NaOH溶液 | |
| B. | 除去Na2O2中的Na2O,加热 | |
| C. | 除去Na2CO3固体中的NaHCO3,加NaOH固体 | |
| D. | 除去Fe、C合金中的C,在O2中灼烧 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源。比如氢气就是一种高效而没有污染的二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源
C.焦炉煤气是一级能源 D.煤是一级能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com