
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性 | |
| B. | 乙中含有化合价为-1的元素 | |
| C. | 丙与氧气的摩尔质量相同,则丙可以是CH3OH | |
| D. | 若丁中含有2种元素且含有ⅣA族元素,则相同条件下丁比甲稳定 |
分析 分子中均含18个电子的甲、乙、丙、丁4种化合物,含有2种或3种元素,其中甲常温下为气态氢化物,乙常温下为液态氢化物,且相对分子质量和甲相同,则甲为H2S,乙为H2O2,结合各物质的结构和性质解答该题.
解答 解:分子中均含18个电子的甲、乙、丙、丁4种化合物,含有2种或3种元素,其中甲常温下为气态氢化物,乙常温下为液态氢化物,且相对分子质量和甲相同,则甲为H2S,乙为H2O2,
A.甲是18电子的氢化物为H2S,其钠盐显碱性,故A正确;
B.乙为H2O2,其中氧元素的价态为-1价,故B正确;
C.氧气的摩尔质量为32 g•mol-1,丙的摩尔质量也为32 g•mol-1,且含有18电子,是CH3OH,故C正确;
D.丁中含有2种元素,且含有ⅣA族元素,丁为SiH4,Si的非金属性小于S,所以相同条件下,甲更稳定,故D错误.
故选D.
点评 本题考查无机物的推断、18电子微粒,题目难度中等,注意常见18电子物质的种类以及性质,解答本题时注意能找出反例,侧重于考查学生的分析能力和对基础知识的应用能力.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
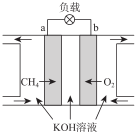
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
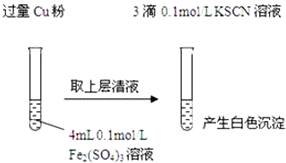
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )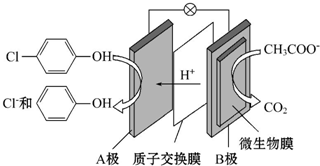
| A. | 该装置能将化学能转化为电能 | |
| B. | A极为正极 | |
| C. | B极上发生氧化反应 | |
| D. | 每有1 mol CH3COO-被氧化,就有8 mol电子通过整个电路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的氨水和NaOH溶液各1.0 L含有的OH-数目均为0.1NA | |
| B. | 常温常压下,由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 22 gD218O分子中,含有质子数和中子数分别为10NA和12NA | |
| D. | 标准状况下,22.4 L CCl4中含有的C-Cl键数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将20mL pH均为1的盐酸和醋酸分别加水稀释至pH为3 | 醋酸的体积变化大 | 醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com