
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+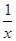 Sx(s) △H=akJ/mol
Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+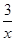 Sx(s) △H=bkJ/mol。
Sx(s) △H=bkJ/mol。
则CO与Sx生成COS反应的热化学方程式是________________________。
(2)有人设想按如图所示装置用废气中的SO2生产硫酸。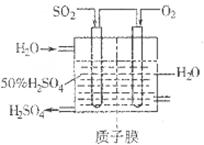
写出SO2电极的电极反应式__________________________。
(3)提高反应2SO2(g)+O2(g)  2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
2SO3(g) △H<0中SO2的转化率是控制SO2排放的关键措施之一。某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5 min后反应达到平衡,二氧化硫的转化率为50%,前5 min内SO2的平均反应速率为___________。
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
_________(填序号)。
a.温度和容器体积不变,充入1.0molHe (g)
b.温度和容器体积不变,充入2molSO2和lmolO2
c.温度和容器体积不变,充入1.0molSO2
d.在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)  2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。
2SO3(g)反应的影响,实验结果如图所示。(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的是____,温度T1______T2(填“>”“<”或“=”)。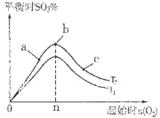
(1)CO(g)+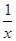 Sx(s)=COS(g) △H=
Sx(s)=COS(g) △H= kJ/mol(2分)
kJ/mol(2分)
(2)SO2-2e-+2H2O=SO42-+4H+(2分)
(3)①0.2mol·L-1·min-1(2分,无单位或单位错误不得分) ②b d(2分)③c(2分) >(2分)
解析试题分析:(1)根据已知反应①SO2(g)+2CO(g)=2CO2(g)+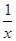 Sx(s) △H=akJ/mol,②2COS(g)+SO2(g)=2CO2(g)+
Sx(s) △H=akJ/mol,②2COS(g)+SO2(g)=2CO2(g)+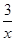 Sx(s) △H=bkJ/mol,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+
Sx(s) △H=bkJ/mol,则根据盖斯定律可知,(①-②)÷2即得到反应CO(g)+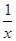 Sx(s)=COS(g),所以该的反应热△H=
Sx(s)=COS(g),所以该的反应热△H= kJ/mol。
kJ/mol。
(2)该装置是原电池,氧气得到电子,在正极通入。SO2失去电子,在负极通入。原电池中阴离子向正极移动,由于存在质子交换膜,因此氢离子在负极生成,所以SO2电极的电极反应式为SO2-2e-+2H2O=SO42-+4H+。
(3)①5 min后反应达到平衡,二氧化硫的转化率为50%,则反应中消耗SO2的物质的量是4mol×50=2mol,其浓度是2mol÷2L=1mol/L,所以前5 min内SO2的平均反应速率=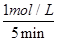 =0.2mol/( L·min)。
=0.2mol/( L·min)。
②a.温度和容器体积不变,充入1.0molHe (g),物质的浓度不变,平衡不移动,所以a不正确;b、温度和容器体积不变,充入2molSO2和lmolO2,则相当于是增大压强,平衡向正反应方向移动,所以SO2的转化率及SO3的平衡浓度都比原来增大,b正确;c、温度和容器体积不变,充入1.0molSO2,平衡向正反应方向移动,三氧化硫的浓度增大,但SO2的转化率降低,c不正确;d、在其他条件不变时,减小容器的容积,压强增大,平衡向正反应方向移动,所以SO2的转化率及SO3的平衡浓度都比原来增大,d正确,答案选bd。
③根据图像可知,b点时三氧化硫的含量最高,继续增大氧气的浓度平衡向正反应方向移动,SO2的转化率增大,所以在a、b、c三点所处的平衡状态中,SO2的转化率最高的是c点。由于该反应是放热反应,升高温度平衡向逆反应方向移动,三氧化硫的含量降低。根据图像可知,在氧气的物质的量相同的情况下,T2曲线表示的三氧化硫含量高,因此温度是T1>T2。
考点:考查热化学方程式的书写、反应速率的计算、外界条件对平衡状态的影响


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:填空题
氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)实验室用如下装置(部分加热、夹持等装置已略去)制备无水氯化铁固体。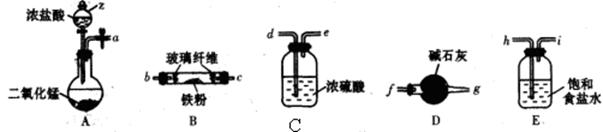
①装置A中仪器z的名称是___________。
②简述检验装置A气密性的操作:______________________。
③按气流方向连接各仪器接口,顺序为a→_________ →__________ →_________ →__________→b→c→_________→__________,装置D的作用是______________________。
(2)工业上制备无水氯化铁的一种工艺流程如下: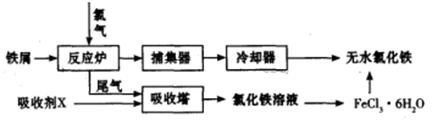
①吸收塔中发生反应的离子方程式为_________________________________________。
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:________________________________。
③用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容;取出10 mL,加入稍过量的KI溶液,充分反应后,滴入指示剂_________(填试剂名称),用c mol/L的Na2S2O3溶液进行滴定,终点时消耗V mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。则样品中氯化铁的质量分数为____________。
(3)若已知:
Fe(OH)3(aq) Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
H2O(l) H+(aq)+OH-(aq) △H=b kJ/mol
H+(aq)+OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 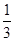 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
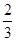 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: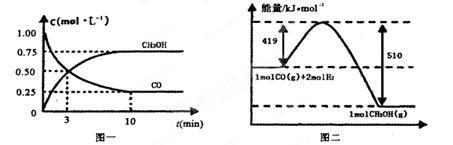
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。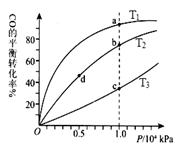
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) ="K(c)" ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1,试写出由
CO2和H2制取甲醇的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题: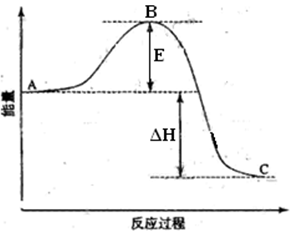
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是 。
(2)图中△H= KJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。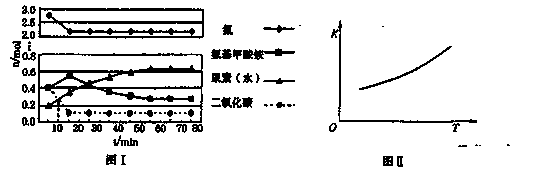
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 
I.已知该产业链中某反应的平衡表常数达式为:K= ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。
830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH =-566 kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ·moL-1
H2O(g)=H2O(l) ΔH =-44.0 kJ·moL-1
(1)氢气的标准燃烧热△H = kJ·moL-1。
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式: 。
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com