
某天然碱(纯净物)可看做由CO2和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:

(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2多少mL(标准状况).
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 112mL(标准状况)和水0.45g,计算并确定天然碱的化学式.
(3)已知Na2CO3和盐酸的反应分下列两步进行:
Na2CO3+HCl=NaCl+NaHCO3
NaHCO3+HCl=NaCl+CO2↑+H2O
由上表中第Ⅳ组数据以及天然碱的化学式,求盐酸的浓度.
(4)讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式.
|
【解答】(1)因第Ⅰ组数据中盐酸过量,故样品质量为2.49g时盐酸仍然过量,样品充分反应,设可产生V mL CO2气体,则有 (2)因2NaHCO3 0.005×2 0.005mol =0.01mol =0.005mol 故3.32g样品中含有H2O的物质的量= 含NaHCO3的物质的量为0.01mol 含Na2CO3的物质的量 = =0.02mol 所以天然碱的Na2CO3,NaHCO3,H2O的物质的量之比为0.02∶0.01∶0.02=2∶1∶2. 故其化学式为2Na2CO3·NaHCO3·2H2O(式量为332) (3)由表中数据可知Ⅳ中盐酸完全反应,盐酸的物质的量等于样品中Na2CO3转化为NaHCO3所消耗盐酸及把部分NaHCO3转化成CO2所耗盐酸的和.则: n(HCl)= c(HCl)= (4)因与1mol样品(2Na2CO3·NaHCO3·2H2O)完全反应需5mol HCl,则和30mL HCl完全反应的样品质量= 所以:①当0<W≤4.98,盐酸与足量样品完全反应,V(CO2)= ②若4.98<W≤12.5时,HCl把部分NaHCO3转化成CO2,V(CO2)=(0.075- ③若W>12.5,样品中Na2CO3足量,盐酸不能将样品中Na2CO3完全转化为NaHCO3,故V(CO2)=0. 【巧解导析】分析表中数据可知,Ⅰ组样品3.32g与Ⅳ组样品7.47g产生的CO2一样多,根据第(3)问所述的反应过程可推第Ⅰ组中盐酸过量,样品完全反应放出CO2;第Ⅳ组中盐酸先将Na2CO3全部转化成NaHCO3后,剩余的盐酸只能把部分NaHCO3转化成CO2,因盐酸完全反应可求出盐酸的浓度.由(2)问的数据可求出样品中Na2CO3,NaHCO3及H2O的物质的量的关系,结合盐酸浓度及天然碱的化学式可确定分步反应时W的特殊值,进行讨论即可求解第(3)问. |
|
【巧解点悟】此题以天然碱的组成及碳酸盐的性质为依托,构筑成一道有层次、有深度且思维容量较大的计算题.要求学生有较强的信息的处理及表格数据的理解、分析能力.解题的关键是根据表格数据分析反应情况及过量情况.若缺乏分析判断能力,则很难解决此题. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:022
某天然碱(纯净物)可看作由 和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生 的体积(标准状况)如下表:
的体积(标准状况)如下表:

(1)由第Ⅰ组数据中的 体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生
体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生 _________(标准状况).
_________(标准状况).
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时 不分解),产生
不分解),产生 (标准状况)和水0.45g,计算并确定该天然碱的化学式.
(标准状况)和水0.45g,计算并确定该天然碱的化学式.
(3)已知 和HCl(aq)的反应分下列两步进行:
和HCl(aq)的反应分下列两步进行:


由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为_____ .
.
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中 (标准状况)体积V(mL)与样品质量W(g)之间的关系式.
(标准状况)体积V(mL)与样品质量W(g)之间的关系式.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
某天然碱(纯净物)可看作由 和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生
和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生 的体积(标准状况)如下表:
的体积(标准状况)如下表:

(1)由第Ⅰ组数据中的 体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生
体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生 _________(标准状况).
_________(标准状况).
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时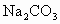 不分解),产生
不分解),产生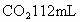 (标准状况)和水0.45g,计算并确定该天然碱的化学式.
(标准状况)和水0.45g,计算并确定该天然碱的化学式.
(3)已知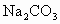 和HCl(aq)的反应分下列两步进行:
和HCl(aq)的反应分下列两步进行:


由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为_____ .
.
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中 (标准状况)体积V(mL)与样品质量W(g)之间的关系式.
(标准状况)体积V(mL)与样品质量W(g)之间的关系式.
查看答案和解析>>
科目:高中化学 来源:2006年5月长沙市高考调研卷1化学试题 题型:038
某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成.称取天然碱样品3.32 g,溶于水后加足量盐酸,测得生成CO2的体积为672 mL(标准状况).另取天然碱3.32 g,用酒精灯加热分解至完全,产生CO2112 mL(标准状况)和水0.45 g.通过计算确定天然碱的化学式.
查看答案和解析>>
科目:高中化学 来源: 题型:
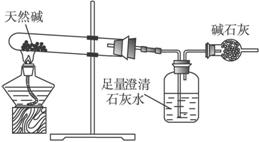
装置Ⅰ
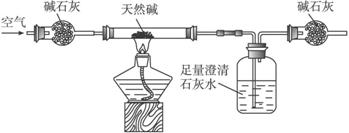
装置Ⅱ
(1)按照上述实验过程,该化学兴趣小组至少使用________次天平。
(2)将天然碱样品加热,冷却至室温,称量其质量为b
(3)你认为选择____________(填“装置Ⅰ”或“装置Ⅱ”)进行实验为佳。选择的理由是___________________________________________________________________。
(4)有一学生在加热过程中对剩余固体进行多次称重(处理数据时已经减去仪器质量),并描出如下图的曲线;
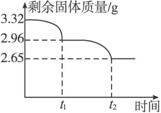
①写出t1→t2反应的化学方程式:________________________________________________。
②通过上述曲线确定天然碱样品的化学式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某天然碱(纯净物)可看作由C02和NaOH反应后的产物所组成.称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生C02的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸溶液的体积(mL) | 30 | 30 | 30 | 30 |
样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(1) 另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(2)已知Na2CO3和HCl溶液的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3
NaHCO3+HCl→NaCl+CO2↑+H2O
由上表第Ⅳ组数据可以确定所用的HCl溶液的浓度为 ____mol?L-1。
(3)依据上表的数据以及天然碱的化学式,讨论并确定上述实验中V(CO2)(mL)与样品质量m(g)之间的关系式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com