
【题目】可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空: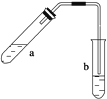
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是?
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是?
(3)实验中加热试管a的目的是:
(4)试管b中加有饱和Na2CO3溶液,其作用是?
(5)反应结束后,振荡试管b,静置。观察到的现象是?
【答案】
(1)
先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,冷却后再加入冰醋酸
(2)
在试管a中加入几片沸石(或碎瓷片)
(3)
①加快反应速率②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向进行
(4)
吸收随乙酸乙酯蒸出的少量乙酸和乙醇并降低乙酸乙酯的溶解度
(5)
b中的液体分层,上层是透明的油状液体
【解析】 (1)浓H2SO4溶解时放出大量的热,因此应先加入乙醇然后边摇动试管边慢慢加入浓H2SO4 , 最后再加入冰醋酸。(2)为了防止发生暴沸应在加热前向试管中加入几片沸石(或碎瓷片)。(3)加热试管可提高反应速率,同时可将乙酸乙酯及时蒸出,有利于提高乙酸乙酯的产率。(4)乙酸乙酯在饱和Na2CO3溶液中溶解度很小,而随乙酸乙酯蒸出的乙酸和乙醇在其中的溶解度很大,因此便于分离出乙酸乙酯。(5)试管内液体分层,上层为油状液体,因为乙酸乙酯的密度小于水的密度。


科目:高中化学 来源: 题型:
【题目】2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂利用汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)N2(g)+2CO2(g)△H
若①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol﹣1
②CO(g)C(s)+ ![]() O2(g)△H2=+110.5kJmol﹣1
O2(g)△H2=+110.5kJmol﹣1
③C (s)+O2(g)CO2(g)△H3=﹣393.5kJmol﹣1
则△H=kJmol﹣1 .
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4 . Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上.这种技术是最初的电化学脱硫技术之一.请写出该电解反应中阴极的电极方程式:
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
①该反应的化学平衡常数表达式:K=
②图中A点时,SO2的转化率为
③计算SO2催化氧化反应在图中B点的压强平衡常数K=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)vA逆) (填“>”、“<”、“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇和酚在人类生产和生活中扮演着重要的角色,根据醇和酚的概念和性质回答下列问题。
(1)下列物质属于醇类的是。
(2)司机酒后驾车时可检测他呼出的气体,所利用的化学反应如下:
2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O
被检测的气体成分是 , 上述反应中的氧化剂是 , 还原剂是。
(3)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为:  用没食子酸制造墨水主要利用了( )类化合物的性质(填代号)。
用没食子酸制造墨水主要利用了( )类化合物的性质(填代号)。
A.醇
B.酚
C.油脂
D.羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:  已知:①
已知:① 
②E的棱磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环.
回答下列问题:
(1)由A生成B的化学方程式为 ,其反应类型为 .
(2)D的化学名称是 ,由D生成E的化学方程式为 .
(3)J的结构简式为 .
(4)G的同分异构体中棱磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应的结构筒式为(写出一种即可)
(5)由甲醛和化合物A经下列步骤可得到2一苯基乙醇. A ![]() K
K ![]() L
L ![]()
![]() CH2CH2OH反应条件1为 ;反应条件2所选择的试剂为;L的结构简式为 .
CH2CH2OH反应条件1为 ;反应条件2所选择的试剂为;L的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115℃~125℃,反应装置如右图。下列对该实验的描述错误的是( )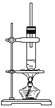
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按上图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)配制①中混合溶液的方法为;
反应中浓硫酸的作用是;
写出制取乙酸乙酯的化学方程式:。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是;
步骤③所观察到的现象是;
欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有;分离时,乙酸乙酯应从仪器(填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
实验 | 乙醇(mL) | 乙酸(mL) | 乙酸 |
① | 2 | 2 | 1.33 |
② | 3 | 2 | 1.57 |
③ | 4 | 2 | x |
④ | 5 | 2 | 1.76 |
⑤ | 2 | 3 | 1.55 |
表中数据x的范围是;实验①②⑤探究的是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B、A与X均可形成10个电子化合物;B的最高价含氧酸可与其气态氢化物反应生成盐,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液先变红后褪色. 用元素符号或化学式回答下列问题.
(1)X在周期表中的位置是;
(2)化合物Y2X2的电子式为 , 它含有的化学键类型有(填序号). A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)X、Z的简单氢化物中沸点较高的是(填化学式),原因是 .
(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为:;
(5)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图所示装置进行石油分馏的实验. 
(1)指出实验装置中仪器A、B、C、D的名称: A、B、C、D .
(2)指出该同学所设计的实验装置中存在的错误,并给予改正. 错误:①;② .
改正:①;②
(3)实验装置改正后,进行气密性检查的方法: .
(4)蒸馏烧瓶中放入几片碎瓷片的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com