
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
分析 ①无色溶液中不存在有色的高锰酸根离子;
②能使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
③加入Al能放出H2的溶液中为酸性或碱性溶液,碳酸氢根离子与氢离子和氢氧根离子反应,铵根离子与氢氧根离子反应;
④四种离子之间不反应,能够共存;
⑤铁离子与碳酸氢根离子、硫氰根离子反应;
⑥pH=12的溶液中存在大量氢氧根离子,亚铁离子、铝离子与氢氧根离子反应.
解答 解:①MnO4-为有色离子,在溶液中不能大量共存,故①错误;
②能使酚酞变红的溶液中存在大量氢氧根离子,CO32-、Na+、AlO2-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,HCO3-、NH4+离子与氢氧根离子反应,HCO3-与氢离子反应,在溶液中不能大量共存,故③错误;
④Na+、Ba2+、Cl-、Cu2+离子之间不反应,在溶液中能够大量共存,故④正确;
⑤有较多Fe3+的溶液中,Fe3+与SCN-、HCO3-离子反应,在溶液中不能大量共存,故⑤错误;
⑥pH=12的溶液中存在电离氢氧根离子,Fe2+、Al3+与氢氧根离子反应,在溶液中不能大量共存,故⑥错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化碳通入水玻璃可以制得硅酸 | |
| D. | 水泥、玻璃、水晶饰物都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子中共价键比氯化钠中离子键弱 | |
| B. | 水的相对分子质量比氯化钠的小 | |
| C. | 水分子间有范德华力,氯化钠分子间的作用力较强 | |
| D. | 水分子间是以范德华力相结合,相互作用较弱;氯化钠晶体中,Na+和Cl-以离子键相结合,作用力较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
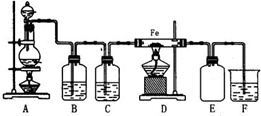 实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Br2的CCl4溶液鉴别CH2=CH2和HC≡CH | |
| B. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
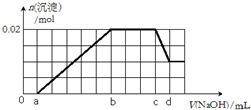 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com