
18.4 g NaOH 和 NaHCO3 固体混合物,在密闭容器中加热到约 250℃,经充分反应后排出气体,冷却,称得剩余固体质量为 16.6 g。试计算原混合物中 NaOH 的质量分数。
54.3%
发生的反应有:①2NaHCO3![]() Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
②2NaOH+CO2![]() Na2CO3+H2O(加热条件下,不生成 NaHCO3)
Na2CO3+H2O(加热条件下,不生成 NaHCO3)
通过极限思维可知,原固体混合物中,NaHCO3 含量越大,固体失重越大,NaOH 含量越大,固体失重越小。
判断 NaHCO3 受热分解产生的 CO2 能否被 NaOH 完全吸收是解决问题的关键,这首先需要写出 NaHCO3 与 NaOH 恰好完全反应的化学方程式。
题设条件下,固体失重:18.4 g-16.6 g = 1.8 g。
设固体失重 1.8 g 需恰好完全反应的 NaHCO3 和 NaOH 混合物质量为 x,则:
![]() NaHCO3+NaOH
NaHCO3+NaOH![]() Na2CO3+H2O
Na2CO3+H2O
124 g 18 g
x 1.8 g
x = ![]() = 12.4 g<18.4 g
= 12.4 g<18.4 g
可见,题设条件下反应发生后 NaOH 过量,过量 NaOH 质量为:
18.4 g-12.4 g = 6.0 g,
参加反应的 NaOH 质量为:![]() ×40.0 g·mol-1 = 4.00 g,
×40.0 g·mol-1 = 4.00 g,
原混合物中 NaOH 质量为:6.0 g+4.00 g = 10.0 g,
w(NaOH) = ![]() ×100% = 54.3%。
×100% = 54.3%。
答案:54.3% 。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
18.4 g NaOH和NaHCO3固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却后称得剩余固体质量为16.6 g,计算原混合物中NaOH的质量分数。
查看答案和解析>>
科目:高中化学 来源:2013届山西省忻州市高三第一次联考化学试卷(带解析) 题型:单选题
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是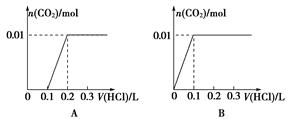
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com