
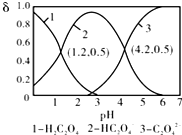
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000 | |
| C. | 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大 | |
| D. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
分析 A.pH=1.2时,H2C2O4、HC2O4-的物质的量分数相等,结合电荷守恒和物料守恒判断;
B.由电离常数可知$\frac{{K}_{{a}_{1}}}{{K}_{{a}_{2}}}$=$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$;
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液氢离子浓度减小,对水的电离抑制的程度减小;
D.KHC2O4和K2C2O4的物质的量相同,但如配成不同浓度的溶液,则pH不一定为4.2.
解答 解:A.pH=1.2时,H2C2O4、HC2O4-的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c(HC2O4-),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),故A正确;
B.由图象可知pH=1.2时,c(HC2O4-)=c(H2C2O4),则Ka1=c(H+)=10-1.2,pH=4.2时,c(HC2O4-)=c(C2O42-),Ka2=c(H+)=10-4.2,
由电离常数$\frac{{K}_{{a}_{1}}}{{K}_{{a}_{2}}}$=$\frac{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}{[c({H}_{2}{C}_{2}{O}_{4)}×c({C}_{2}{{O}_{4}}^{2-})]}$=1000,故B正确;
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故C正确;
D.将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故D错误;
故选D.
点评 本题考查酸碱混合物的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握图象的含义,易错点为B,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 1L0.1 mol/L的NH4NO3溶液中氮原子数小于0.2NA | |
| C. | 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- | |
| D. | 含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
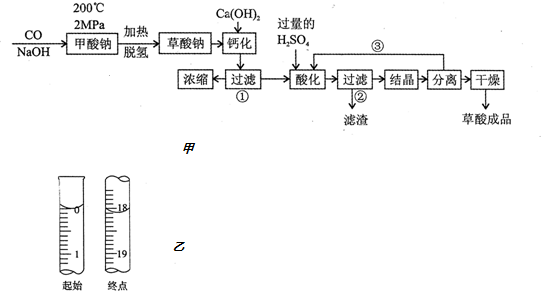
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 816O、817O、818O互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化合物A的分子式为C15H21O3 | |
| B. | 化合物A是芳香族化合物 | |
| C. | 化合物A可以发生取代反应、加成反应、酯化反应和银镜反应 | |
| D. | 1mol化合物A最多可与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
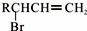 .
.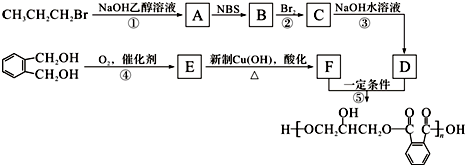
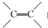 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.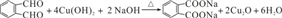 ;
;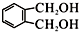 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.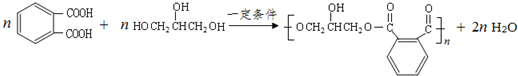 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol HI(g) | B. | 2 mol H2(g)和1 mol I2(g) | ||
| C. | 1 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
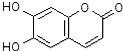
| A. | M的相对分子质量是172 | |
| B. | 1mol M最多能与3mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1mol M与足量Na反应能生成1mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com