
分析 (1)(2)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$结合物质的构成计算;
(3)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变.
解答 解:(1)1个SO2分子含有2个O原子,则3.01×1023个SO2分子中含有氧原子的个数为6.02×1023,n(SO2)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,m(SO2)=0.5mol×64g/mol=32g,
故答案为:6.02×1023;32g;
(2)n(NO2)=$\frac{92g}{46g/mol}$=2mol,n(O)=4mol,N(O)=4NA,故答案为:4NA;
(3)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,根据N=nNA知,各种元素的原子个数之比等于其物质的量之比,n(N):n(O)=n(NO):[n(NO)+2n(O2)]=amol:(a+2b)mol=a:(a+2b),
故答案为:a:(a+2b).
点评 本题考查较综合,涉及物质的量的计算、原子守恒的计算等,为高频考点,侧重分析能力、计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 过量空气有利于SO2转化为SO3 | ||
| C. | 打开汽水瓶盖,即有大量气泡逸出 | D. | 配置FeCl3溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中所含的离子是:Fe2+?Na+?SO42-?NO3-? | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色 | |
| C. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 若向该溶液中加入足量的NaOH 溶液,充分反应后,过滤?洗涤?灼烧,最终所得固体的质量为72g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
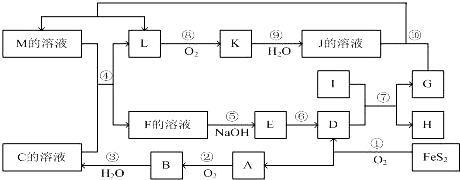
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
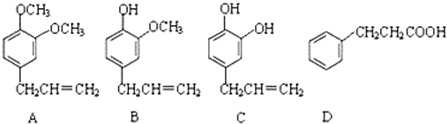
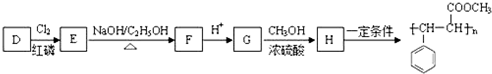
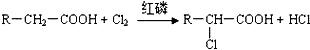
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的原子序数呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的氢离子浓度大于盐酸 | |
| B. | pH值越大,酸性越强 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 酸性溶液中氢离子浓度一定大于氢氧根离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
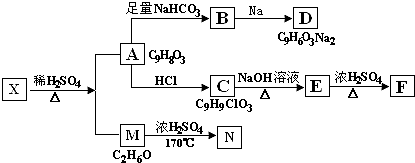
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑;
+H2O+CO2↑;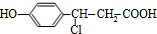 +3NaOH$→_{△}^{H_{2}O}$
+3NaOH$→_{△}^{H_{2}O}$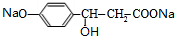 +NaCl+2H2O.
+NaCl+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com