
分析 根据n=cV计算出混合液中硝酸钾、硝酸钡的物质的量,从而可知混合液中硝酸根离子的总物质的量,再根据c=$\frac{n}{V}$计算出混合溶液中NO3-物质的量浓度,根据Na2SO4 +Ba(NO3)2 =BaSO4+2NaNO3求Na2SO4溶液的体积.
解答 解:50mL 0.50mol•L-1的硝酸钾溶液中硝酸钾的物质的量为:0.5mol/L×0.05L=0.025mol,0.025mol硝酸钾中含有0.025mol硝酸根离子,
50mL 0.40mol•L-1Ba(NO3)2的溶液中含有硝酸钡的物质的量为:0.4mol/L×0.05L=0.02mol,0.02mol硝酸钡中含有硝酸根离子的物质的量为:0.02mol×2=0.04mol,
混合过程中硝酸根离子的物质的量不变,则混合液中硝酸根离子的总物质的量为:0.025mol+0.04mol=0.065mol,
混合溶液中NO3-物质的量浓度为:c(NO3-)=$\frac{0.065mol}{0.1L}$=0.65mol/L,
Na2SO4 +Ba(NO3)2 =BaSO4+2NaNO3
1mol 1mol
0.50V 0.02mol
所以$\frac{1mol}{0.50V}=\frac{1mol}{0.02mol}$,解之得V=0.04L,
答:(1)混合溶液中NO3-物质的量浓度为0.65mol/L;
(2)混合前Ba(NO3)2 物质的量浓度为0.40mol•L-1;
(3)需要Na2SO4溶液的体积为0.04L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意溶液混合过程中溶质的物质的量不变,试题培养了学生的化学计算能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 稀硫酸和稀硝酸都具有氧化性 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、NH3等多种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
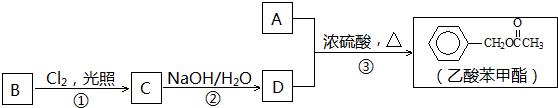
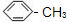 ,②的反应类型为取代(水解)反应.
,②的反应类型为取代(水解)反应.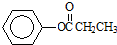 等.
等.
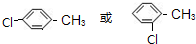 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
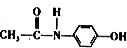 ,有关它的性质描述错误的是( )
,有关它的性质描述错误的是( )| A. | 与对硝基乙苯互为同分异构体 | |
| B. | 1mol该物质与浓溴水反应时最多消耗Br23mol | |
| C. | 它能与NaOH溶液反应 | |
| D. | 其水解产物之一对氨基苯酚(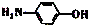 )具有弱酸性、弱碱性 )具有弱酸性、弱碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L的CH3COOH溶液中加入少量CH3COONa固体,溶液pH增大 | |
| B. | 在密闭容器中充入一定量NO2建立2NO2(g)?N2O4(g)平衡后,增大压强,体系颜色加深 | |
| C. | 向水中投入金属Na,最终溶液呈碱性 | |
| D. | 在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60ml 0.1mol/L的HCl溶液 | B. | 30ml 0.1mol/L的AlCl3溶液 | ||
| C. | 20ml 0.1mol/L的MgCl2溶液 | D. | 10ml 0.2mol/L的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C16H25O5 | B. | C14H16O4 | C. | C14H18O5 | D. | C16H25O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价键只存在于共价化合物中 | |
| B. | 共价化合物中既可能存在离子键,也可能存在共价键 | |
| C. | 共价化合物中一定存在共价键 | |
| D. | 共价化合物中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
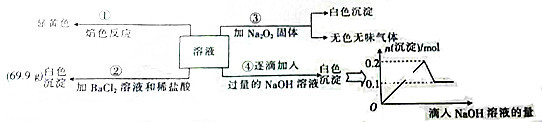
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com