
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
科目:高中化学 来源: 题型:
进行化学实验必须注意安全,下列几种处理事故的方法正确的是
①浓H2SO4滴到皮肤上,先用水冲洗,再用布擦干 ②酒精不小心洒在实验桌上,并燃烧起来,应立即用水扑灭 ③不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 ④镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 ⑤实验时不慎被玻璃划破手指,引起轻微流血时,用三氯化铁溶液涂抹止血
A.①② B.②④⑤
C.③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Fe、Fe2O3、CuO的混合物放入体积为100 mL、浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896 mL(标准状况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(滤液体积仍为100 mL)。向滤液中滴加2.0 mol/L的NaOH溶液至30 mL时开始出现沉淀。则未滴加NaOH 溶液前滤液中FeSO4的物质的量浓度为
( )
A.2.0 mol/L B.1.8 mol/L
C.1.9 mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是 ( )
A.NaOH B.NaCl
C.H2O D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
新制氯水与久置的氯水相比较,下列结论不正确的是 ( )
A.颜色相同 B.前者能使有色布条褪色
C.都含有H+ D.加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?
(2)待测Na2CO3溶液的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
以黄铁矿为原料生产硫酸的工艺流程图如下:
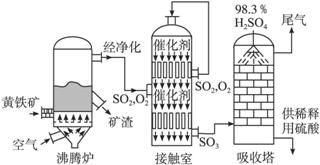
(1)将燃烧黄铁矿的化学方程式补充完整
4________+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是__________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。计算:该铵盐中氮元素的质量分数是___________%;若铵盐质量为15.00 g,浓硫酸增加的质量为___________。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com