
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | Fe+2HCl═FeCl2+H2↑ | ||
| C. | MnO2+4HCl (浓)═MnCl2+Cl2↑+2H2O | D. | NaOH+HCl═NaCl+H2O |
科目:高中化学 来源: 题型:解答题
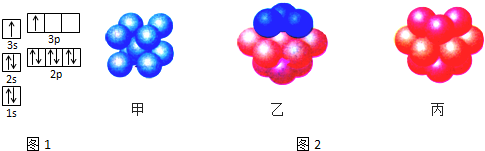
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
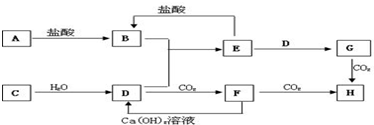
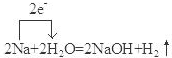 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 1molCO2和NO2的混合物中含的氧原子数为4NA | |
| C. | 标准状况下,NA个CCl4分子所占的体积约为22.4L | |
| D. | 54g H2O中含有3NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取烧杯内液体,加入BaCl2溶液产生白色沉淀 | |
| B. | 取烧杯内液体,加入碘水不变蓝 | |
| C. | 取半透膜内液体,加入BaCl2溶液没有白色沉淀 | |
| D. | 取半透膜内液体,加入碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

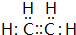 ,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O
,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原试管有4mL NO2 | B. | 6mL气体全部是N2 | ||
| C. | 原试管有6mL NO2 | D. | 剩余6mL气体是NO和N2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com