
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.1 mol Cl2参加反应转移电子数一定为2NA
B.CO2通过Na2O2使其增重b g时,反应中转移的电子数为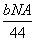 个
个
C.标准状况下,含NA个氩原子的氩气体积约为22.4 L
D.一定条件下,Al与Fe3O4反应,生成5.6 g Fe,转移0.3NA个电子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列4种装置工作一段时间后,测得导线上均通过了0.002 mol 电子,此时溶液的pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)①盛100 mL CuSO4 ②盛200 mL 0.01 mol·L-1 H2SO4 ③盛200 mL ZnCl2 ④盛200 mL NaCl饱和溶液( )
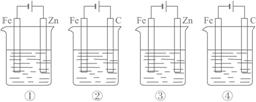
A.④②③① B.④③①② C.④③②① D.④①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )
A.54.5% B.40%
C.36% D.33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO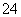 、
、
Cl-、NO 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
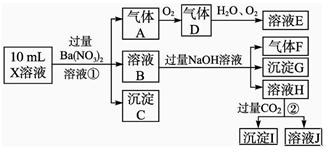
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.石灰石溶于醋酸:CaCO3+2CH3COOH===2CH3COO-+Ca2++CO2↑+H2O
B.钠与硫酸铜溶液反应:Cu2++2Na===2Na++Cu
C.铁屑溶于过量稀硝酸:3Fe+8H++2NO ===3Fe2++2NO↑+4H2O
===3Fe2++2NO↑+4H2O
D.FeI2溶液中通入少量氯气:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O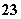 和Cl2反应的产物之一为SO
和Cl2反应的产物之一为SO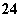 。下列说法不正确的是( )
。下列说法不正确的是( )
A.该反应中还原剂是S2O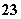
B.H2O参与该反应,且作氧化剂
C.根据该反应可判断氧化性:Cl2 > SO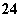
D.上述反应中,每生成1 mol SO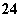 ,可脱去2 mol Cl2
,可脱去2 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,
由此可知
A.x的原子半径大于y的原子半径 B.x的电负性大于y的电负性
C.x阴离子的半径小于y阳离子的半径 D.x的第一电离能小于y 的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
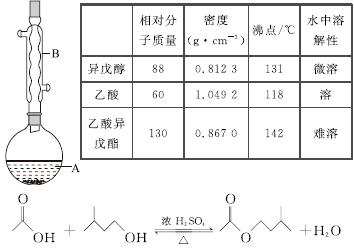
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
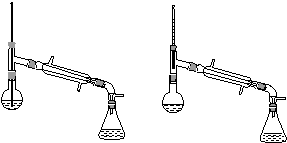
a. b.
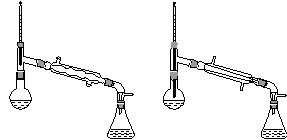
c. d.
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏__________(填“高”或“低”),其原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com