
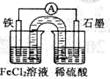
某原电池装置如右图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针无偏转
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
反应mA(g)+ nB(g) 
 pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
A.2A(g)+ 6B(g)
 3C(g)+5D(g)
3C(g)+5D(g)
B.3A(g)+ B(g)
 2C(g)+2D(g)
2C(g)+2D(g)
C.3A(g)+ B(g) 
 2C(g)+ D(g)
2C(g)+ D(g)
D.A(g)+ 3B(g)
 2C(g)+2D(g)
2C(g)+2D(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①过量Na2O2投入到FeCl2溶液中 ②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2SiO3溶液中通入过量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2
A.全部 B.①⑤ C.②③④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应N2(g)+O2(g)==2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
A.降低体系温度 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
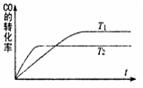
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g) 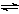 CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
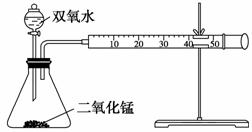
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
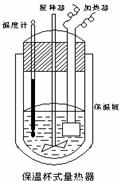 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象及其对应的结论正确的是
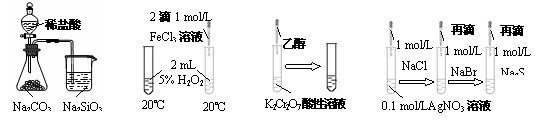 |
A B C D
| 实验 | 现象 | 结论 |
| A | 锥形瓶中有气体产生,烧杯中液体变浑浊 | Cl、C、Si非金属性依次减弱 |
| B | 右边试管中冒出的气泡快 | FeCl3能加快H2O2分解速率 |
| C | 试管中橙色溶液变为绿色 | 乙醇发生消去反应生成乙烯 |
| D | 试管中溶液依次出现白色、淡黄色、黑色沉淀 | 溶解度:AgCl<AgBr<Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的x值:
| 元素 符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| X 值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.50 | 3.16 |
(1)通过分析x值变化规律,确定N、Mg的x值范围______<x(Mg)< _,_____<x(N)<_____。
(2)推测x值与原子半径的关系是 ;根据短周期元素的x值变化特点,体现了元素性质的 变化规律。
(3)某有机化合物结构式为 ,其中S—N中,你认为共用电子对偏向谁?_______(写原子名称)。
,其中S—N中,你认为共用电子对偏向谁?_______(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素在周期表中的位置:________(放射性元素除外)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com