
| A. |  用图装置萃取溴水中的溴,并把溴的苯溶液从下口放出 | |
| B. |  用图装置可以验证溴乙烷发生了消去反应 | |
| C. |  用图装置配制银氨溶液 | |
| D. |  用图装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
分析 A.苯的密度比水小,应从上口到出;
B.乙醇易挥发,也可被酸性高锰酸钾氧化;
C.试剂滴加顺序错误;
D.浓硫酸使蔗糖碳化,且发生氧化还原反应生成二氧化硫,可使品红褪色,二氧化硫具有还原性,可与高锰酸钾发生氧化还原反应.
解答 解:A.苯的密度比水小,溴的苯溶液应从上口到出,故A错误;
B.乙醇易挥发,也可被酸性高锰酸钾氧化,如不能除去乙醇,则不能直接得出结论,故B错误;
C.试剂滴加顺序错误,应在硝酸银溶液中滴加氨水,故C错误;
D.浓硫酸使蔗糖碳化,且发生氧化还原反应生成二氧化硫,可使品红褪色,二氧化硫具有还原性,可与高锰酸钾发生氧化还原反应,可完成实验,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及实物质的分离、检验、制备等知识,把握物质的性质、反应原理、实验基本技能为解答的关键,侧重实验评价分析的考查,注意实验装置的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
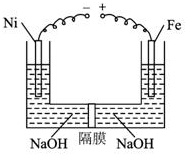 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
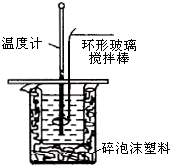 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝合金强度大,质量轻,不与氧气反应 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向次氯酸钙溶液中通入过量CO2:2ClO-+Ca2++H2O+CO2═2HClO+CaCO3↓ | |
| C. | 向含0.015 molNaOH的溶液中通入0.64 g SO2:3OH-+2SO2═SO32-+HSO3-+H2O | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| B. | 二氧化硫具有还原性,能用于漂白纸浆 | |
| C. | 碳酸钠能和酸反应,常用于治疗胃酸过多 | |
| D. | 氧化铝熔点很高,用其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.
(1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com