
下列表述正确的是
A、碳酸氢根离子的电离方程式可表示为:HCO3-+H2O H3O++CO32-
H3O++CO32-
B、酸性条件下,KIO3溶液与KI溶液反应生成I2的离子方程式为:IO3-+5I-+3H2O=I2+6OH-
C、氯气具有酸性,可与烧碱溶液或石灰乳反应制备含氯消毒剂
D、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
科目:高中化学 来源:2013-2014江苏宿迁市高一下学期期末测试化学试卷(解析版) 题型:实验题
(12分)完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:

(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、
(写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:填空题
(8分)按要求填写空白:
(1)写出醋酸钠在水中发生水解反应的离子方程式:____________。
(2)浓度均为0.1mol/L的下列4种物质的水溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
pH由大到小的顺序是_________(填数字序号)。
(3)在①H2O ②HCHO ③Cl2 ④C2H2 ⑤CCl4分子中:
全部以非极性键结合的非极性分子是_________(填数字序号,下同);
全部以极性键相结合,具有V形分子立体构型的是________;
中心原子为sp3杂化的非极性分子是_________;
中心原子为sp2杂化的极性分子是________;
既有极性键又有非极性键的非极性分子是_____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市下学期高二年级期末考试化学试卷(解析版) 题型:选择题
符合下列情况的化学反应一定能自发进行的是
A. △H<0、△S>0 B. △H<0、△S<0
C. △H>0、△S<0 D. △H>0、△S>0
查看答案和解析>>
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:简答题
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。

(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X
B.M、X、Z三种元素形成的单质熔点:X>M>Z
C.Y、Z两种元素的含氧酸酸性:Z>Y
D.Y、Z两种元素的单核阴离子还原性:Y>Z
(3)元素W与M按原子个数比1:l形成的化合物的电子式为 。
(4)元素X与Z形成的五原子分子的空间结构属于 形。
(5)与Z同族的元素都能与氢元素形成氢化物,其中水溶液酸性最弱的是 (填化学式)。
(6)含有N元素的两种离子在溶液中相遇能快速发生反应,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东肇庆市毕业班第二次模拟考试理综化学试卷(解析版) 题型:实验题
.(16分)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)2 | 7.0 | 9.0 |
Fe(OH)3 | 1.9 | 3.2 |
Cr(OH)3 | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如下图所示:
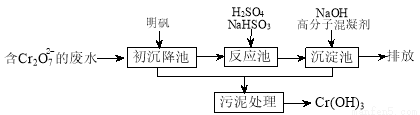
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
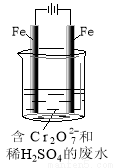
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东肇庆市毕业班第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列陈述和判断均正确,且有因果关系的是( )
选项 | 陈述 | 判断 |
A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
B | 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
C | 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
分类是化学学习与研究的常用方法,下列分类正确的是 ( )
| A.Na2O、CaO、Al2O3均属于碱性氧化物 |
| B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.烧碱、纯碱均属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
12分)某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步:
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com