
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:

下列说法正确的是
A. Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl
B.相同条件下电离程度比较:HCO3->HSO3->HClO
C.6种溶液中,Na2SiO3溶液中水的电离程度最小
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
【答案】A
【解析】
试题分析:A、根据盐溶液的pH可知,酸性是碳酸强于次氯酸,次氯酸强于碳酸氢根,则氯气与碳酸钠按物质的量之比为1:1反应的方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl,A正确;B、酸越弱,相应的盐越容易水解,溶液的碱性越强,则根据pH大小可知酸性是HSO3->HClO>HCO3-,B错误;C、6种溶液中,Na2SiO3溶液的碱性最强,水解程度增大,则水的电离程度最大。C错误;D、亚硫酸氢钠溶液显酸性,说明电离程度大于水解程度,则离子浓度大小顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),D错误,答案选A。
考点:考查盐类水解应用、溶液中离子浓度大小比较


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2 、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
A.4 mo1 B.5 mo1 C.6 mo1 D.7 mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.目前使用的元素周期表中,最长的周期含有36种元素.
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝制易拉罐收集满CO2,快速加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响,并变瘪了:过一会儿,易拉罐又会作响并鼓起来。下列说法正确的是
A.导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3-
B.导致易拉罐又鼓起来的反应是: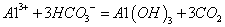
C.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
D.上述过程中与NaOH溶液反应的物质有三种,且反应结束后的溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”), ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时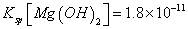 mol3
mol3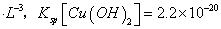 mol3.L-3).
mol3.L-3).
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列装置能达到预期目的的是( )
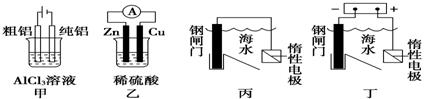
A.甲图装置可用于电解精炼铝 B.乙图装置可得到持续、稳定的电流
C.丙图装置可达到保护钢闸门的目的 D.丁图装置可达到保护钢闸门的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体区别于其它分散系的实质是( )
A.胶体可发生丁达尔效应 B.胶体粒子能够发生布朗运动
C.胶体能透过滤纸但不能透过滤纸 D.胶体粒子直径在1nm-100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A.1∶6 B.1∶7 C.2∶11 D.16∶25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com