
【题目】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图一装置制备氨气并探究相关性质。
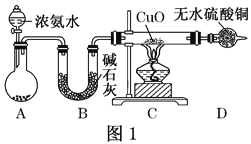
(1)装置A中,盛有浓氨水的仪器名称为_____,烧瓶内药品可选用______。装置B的作用是______。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____(填I或Ⅱ)。
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为______,该反应证明氨气具有______性;氨跟氧气的反应也体现了这一性质,反应方程式为______。
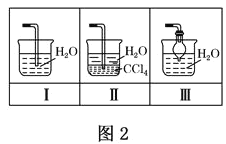
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_____(填装置序号)。
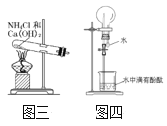
(5)实验室还可用图三所示装置制备氨气,化学反应方程式为_____;用圆底烧瓶收集干燥的氨气,用图四装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因(用方程式表示)是______。
(6)尿素CO(NH2)2是一种常用化肥,缓慢与水发生非氧化还原反应释放出氨气,则尿素中C的化合价为价_____。
【答案】分液漏斗 碱石灰或生石灰 干燥氨气 I 3CuO+2NH3![]() 3Cu+N2+3H2O 还原 4NH3+5O2
3Cu+N2+3H2O 还原 4NH3+5O2![]() 4NO+6H2O Ⅱ、Ⅲ 2NH4Cl+Ca(OH)2
4NO+6H2O Ⅱ、Ⅲ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O ![]() +4
+4
【解析】
浓氨水在碱石灰或生石灰的作用下挥发生成氨气,在B中用碱石灰干燥,在C中加热与氧化铜发生氧化还原反应生成水、氮气和铜,D可用于检验是否生成水,最后氨气用水吸收,因氨气极易溶于水,注意防止倒吸;NH4Cl与Ca(OH)2在加热条件下反应生成氯化钙、氨气、水,氨气为碱性气体,极易溶于水,可据此做喷泉实验。
(1)根据仪器装置图可知,盛有浓氨水的仪器名称为分液漏斗;浓氨水在碱石灰或生石灰的作用下挥发生成氨气,生成的氨气中含有水分,若直接通入C中,会导致C中石英管破裂,因此选用碱石灰进行干燥,故答案为:分液漏斗;碱石灰或生石灰;干燥氨气;
(2)整个装置中含有空气,连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,通过氧化铜的颜色变化分析氨气的性质,故答案为:I;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3![]() 3Cu+N2+3H2O;氮元素化合价升高为0价,作还原剂具有还原性;氨气与氧气反应生成NO、H2O,其反应方程式为:4NH3+5O2
3Cu+N2+3H2O;氮元素化合价升高为0价,作还原剂具有还原性;氨气与氧气反应生成NO、H2O,其反应方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:3CuO+2NH3
4NO+6H2O,故答案为:3CuO+2NH3![]() 3Cu+N2+3H2O;还原;4NH3+5O2
3Cu+N2+3H2O;还原;4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(5)NH4Cl与Ca(OH)2在加热条件下反应生成氯化钙、氨气、水,其反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气为碱性气体,其溶于水生成一水合氨,一水合氨发生电离使溶液呈碱性,使含有酚酞的溶液呈红色,一水合氨的电离方程式为:
CaCl2+2NH3↑+2H2O;氨气为碱性气体,其溶于水生成一水合氨,一水合氨发生电离使溶液呈碱性,使含有酚酞的溶液呈红色,一水合氨的电离方程式为:![]() ,故答案为:2NH4Cl+Ca(OH)2
,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;![]() ;
;
(6)其反应为非氧化还原反应,说明N元素化合价为-3价,H元素化合价为+1价,O元素化合价为-2价,根据化合物中化合价代数和为0可知C元素化合价为+4价。


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)+270KJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270KJ
D.该反应过程的能量变化可用图来表示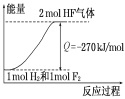
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
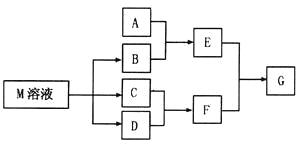
(1)写出用惰性电极电解M溶液的离子方程式_______________________。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_________________。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是__________________________________。
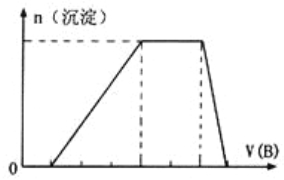
(5)若A是一种溶液,只可能含有![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子一定能大量共存的是( )
A.含大量H+的溶液中:Na+、K+、SO42-、HCO3-
B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C.能使酚酞变红的溶液中:Na+、NO3-、K+、AlO2-
D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) ![]() CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________(填“>”或“<”)0,△H1=________(用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
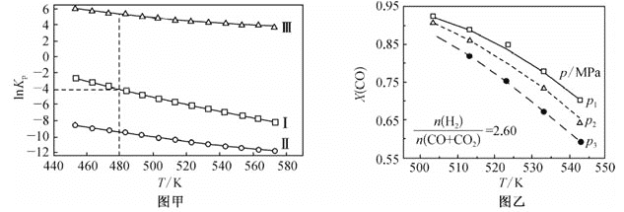
①反应(Ⅱ)的△H________(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制 ![]() =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大 ![]() ,X(CO)增大
,X(CO)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某带结晶水的固体X(含四种短周期元素)的组成和性质,设计并完成如下实验

请回答:(1)白色固体D是________。
(2)无色溶液![]() 白色沉淀F的离子方程式是________。
白色沉淀F的离子方程式是________。
(3)X的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
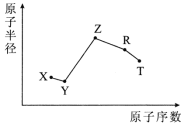
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
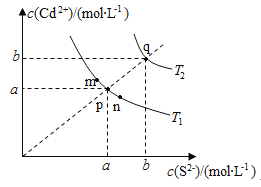
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com