
����Ŀ��ij��ѧ��ȤС��������ͼ1ʵ��װ�ý�����ȡ����غ���֤Ԫ�صķǽ��������ǿ�������飮 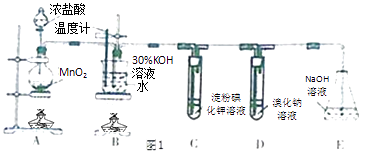
��1��Aװ���з�Ӧ�����ӷ���ʽΪ��Bװ�ò���ˮԡ���ȵ��ŵ��� ��
��2����ȡʵ�������ȡ��B���Թ���ȴ�ᾧ�����ˡ�ϴ�ӣ���ʵ�����������Ҫ�IJ��������� ��
��3�����Ե�B��Cװ�õ�λ�ã�����ܡ����ܡ������B������صIJ��ʣ�
��4����֤�ǽ�����Cl��I��ʵ�������� �� ��װ������ܡ����ܡ�����֤�ǽ�����Cl��Br��I��
��5��������ͼ2װ����֤�ǽ����ԣ�C��Si��B�м�Na2CO3 �� C�м�Na2SiO3��Һ��A��Ӧ�ü��� �� C�з�Ӧ�Ļ�ѧ����ʽ �� 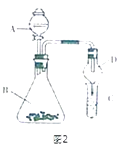
���𰸡�
��1��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O���¶��أ����Ⱦ���
Mn2++Cl2��+2H2O���¶��أ����Ⱦ���
��2���ձ���©��������������ͷ�ι�
��3����
��4��C����Һ����ɫ������
��5��ϡH2SO4��CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3
���������⣺Aװ�ã���Ũ����Ͷ������̼�����ȡ������Bװ�ã�ʢ������������Һ���������ȼӦ����������أ�Cװ�ã�ʢ�ŵ��۵⻯����Һ��������KI��Һ�ķ�Ӧ�����ɵⵥ�ʣ��ⵥ�������������ʾ��ɫ��Dװ�ã�Cl2+2Br��=Br2+2Cl�� �� �����ж�������ֱ���ŷŵ������У���ʢ��NaOH��Һ��Eװ������β������1��ʵ������Ũ����Ͷ������̼�����ȡ��������Ӧ����ʽΪMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��A�з�Ӧ�����ӷ���ʽΪ��MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O��A�з�Ӧ�����ӷ���ʽΪ��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O����Ӧ���¶Ȳ�����100�ȵķ�Ӧ������ֱ�Ӽ����¶ȹ��ߣ���Ӧ�¶����Կ��ƣ�ˮԡ���ȣ���Ӧ���¶Ⱥܺÿ��ƣ����Ⱦ��ȣ����Դ��ǣ�MnO2+4H++2Cl��
Mn2++Cl2��+2H2O����Ӧ���¶Ȳ�����100�ȵķ�Ӧ������ֱ�Ӽ����¶ȹ��ߣ���Ӧ�¶����Կ��ƣ�ˮԡ���ȣ���Ӧ���¶Ⱥܺÿ��ƣ����Ⱦ��ȣ����Դ��ǣ�MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O���¶��أ����Ⱦ��ȣ���2����ȡʵ�������ȡ��B���Թܣ�������ȴ�ᾧ������Ҫ�ձ���������Ҫ©���Ͳ�������ϴ����Ҫ���������ձ�ʢ��Һ�壬���ò��������������ý�ͷ�ι���ȡ����Һ�壬���Դ��ǣ��ձ���©��������������ͷ�ιܣ���3��ʵ�����ö������̺�Ũ��������ȡ�������Ƶõ������к����Ȼ��⣬HCl��������ˮ���ܺ�KOH��Ӧ����KCl���ʣ����Ե�B��Cװ�ã����Գ�ȥ�Ȼ������ʣ������B������صIJ��ʣ����Դ��ǣ��ܣ���4��������ԭ��Ӧ�У��������������Դ�����������������ԣ�װ��C�У������ѵ������û��ɵ��ʵ⣬Cl2+I��=I2+2Cl�� �� �������۱�������֤�ǽ�����Cl��I�����װ����û���嵥������ε��û���Ӧ��������֤��Br��I�����Դ��ǣ�C����Һ����ɫ�����ܣ���5������ǿ��������ԭ������ƿ�м�CaCO3 �� A��Һ���̼��Ʒ�Ӧ��ȡ������̼����ѡ��ϡ���ᣬ�Թ���ʢװ��������Һ������̼�����Աȹ���ǿ����C��ͨ�������̼�������ɹ����������Ӧ�ķ���ʽΪCO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 �� ���Դ��ǣ�ϡH2SO4��CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 ��
Mn2++Cl2��+2H2O���¶��أ����Ⱦ��ȣ���2����ȡʵ�������ȡ��B���Թܣ�������ȴ�ᾧ������Ҫ�ձ���������Ҫ©���Ͳ�������ϴ����Ҫ���������ձ�ʢ��Һ�壬���ò��������������ý�ͷ�ι���ȡ����Һ�壬���Դ��ǣ��ձ���©��������������ͷ�ιܣ���3��ʵ�����ö������̺�Ũ��������ȡ�������Ƶõ������к����Ȼ��⣬HCl��������ˮ���ܺ�KOH��Ӧ����KCl���ʣ����Ե�B��Cװ�ã����Գ�ȥ�Ȼ������ʣ������B������صIJ��ʣ����Դ��ǣ��ܣ���4��������ԭ��Ӧ�У��������������Դ�����������������ԣ�װ��C�У������ѵ������û��ɵ��ʵ⣬Cl2+I��=I2+2Cl�� �� �������۱�������֤�ǽ�����Cl��I�����װ����û���嵥������ε��û���Ӧ��������֤��Br��I�����Դ��ǣ�C����Һ����ɫ�����ܣ���5������ǿ��������ԭ������ƿ�м�CaCO3 �� A��Һ���̼��Ʒ�Ӧ��ȡ������̼����ѡ��ϡ���ᣬ�Թ���ʢװ��������Һ������̼�����Աȹ���ǿ����C��ͨ�������̼�������ɹ����������Ӧ�ķ���ʽΪCO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 �� ���Դ��ǣ�ϡH2SO4��CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�������������
A. C2H6 B. CH3CH2OH
C. CH3COOH D. CH3COOCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ֽ����Ͳġ����ڿ������ܹ��ȶ����ڵ�ԭ���ǣ� ��
A. ���Ļ����Ժܲ� B. ���Ļ�ԭ�Ժܲ�
C. ������������Ӧ D. �����������ܵ�����Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����У��˴Ź���������3�����շ���ǣ� ��
A.����B.�Ҵ�C.��ϩD.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء�����˵������ȷ���ǣ� ��
A.���ع��ͻ��ռӹ���ȼ�ϣ��������Դ��������
B.�ƹ�ʹ�þ�̼�����ȿɽ������ϣ��ɼ�������ɫ��Ⱦ��
C.ú�ĸ�����ʯ�͵ķ�������ڻ�ѧ�仯
D.�������ÿ�������Դ�����ٻ�ʯȼ�ϵ�ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Z��Q��R��T��U�ֱ����ԭ��������������Ķ�����Ԫ�أ����ڱ���ȫ��Ԫ����X��ԭ�Ӱ뾶��С��X��R��������������ȣ�Z���ڲ��������������������һ�룬U������ϼۺ���ͻ�����Ĵ�����Ϊ6��R��Q����ԭ����֮��Ϊ1��1��2��1�����ֻ����R��T��U���ߵ�����������Ӧ��ˮ��������֮���ܷ�����ѧ��Ӧ�� ��ش��������⣺
��1��TԪ�����ڱ��е�λ������������Ԫ���е�����Ԫ���γɵļȺ������Ӽ��ֺ��й��ۼ��Ļ�����Ϊ��д������һ�����ʵ����ƣ���
��2��X��Z��Q����Ԫ�ص�ԭ�Ӱ뾶��С����˳��Ϊ����Ԫ�ط��ţ���
��3��T��U��Ԫ������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ ��
��4�����п����ж�R��T������ǿ������������ţ��� a�����ʵ��۵�R��T��
b���������ᷴӦʱ��ʧ������R��T��
c��������ˮ��ӦR��T����
d������������ˮ����ļ���R��Tǿ
��5��ijͬѧ��Q��R��Ԫ�صĵ��ʷ�Ӧ���ɹ�������R2Q2 �� R2Q2�������ӻ���������뻯����X2Q��Ӧ����Q�ĵ��ʣ�R2Q2�ĵ���ʽΪ��R2Q2��X2Q��Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ȼ�ϵ�ع���ʱ��װ����ͼ��ʾ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������١���ش��������⣺
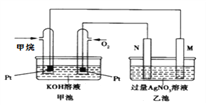
��1�����缫Ϊ�ҳ���___�缫������M������N������N���ĵ缫��ӦʽΪ____________��ͨ�����IJ��缫�ĵ缫��ӦʽΪ____��
��2���ڴ˹����У��ҳ���ijһ�缫����������4.32gʱ���׳�����������������_______L����״���£�������ʱ�ҳ���Һ�����Ϊ400mL�����ҳ�����Һ��c(H+)Ϊ___mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�Ũ�Ⱦ�Ϊ1 molL-1��A2��B2�������壬���ܱ������з�Ӧ��������C����Ӧ�ﵽƽ���ã�c(A2)="0.58" molL-1��c(B2)="0.16" molL-1��c(C)=0.84molL-1����÷�Ӧ����ȷ����ʽΪ��
A. 2A2+B2![]() 2A2B B. A2+B2
2A2B B. A2+B2![]() 2AB
2AB
C. A2+B2![]() A2B2 D. A2+2B2
A2B2 D. A2+2B2![]() 2AB2
2AB2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���Ӧ2HI��g��![]() H2��g��+ I2��g��������Ӧ���ȣ��ﵽƽ��ʱ��Ҫʹ����������ɫ����ɲ�ȡ�Ĵ�ʩ��: ������������Ũ�� �������¶� �������¶� ����С��� ������HI��Ũ�� ����Сѹǿ
H2��g��+ I2��g��������Ӧ���ȣ��ﵽƽ��ʱ��Ҫʹ����������ɫ����ɲ�ȡ�Ĵ�ʩ��: ������������Ũ�� �������¶� �������¶� ����С��� ������HI��Ũ�� ����Сѹǿ
A. �٢ۢ� B. �ۢݢ� C. �٢ۢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com