
下列实验操作合理或能达到实验目的的是 ( )
A.用激光笔检验某KI溶液中是否溶有淀粉
B.配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗
C.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI)
D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列反应,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3 + H2O = H2SO4
B.2Na2O2 + 2H2O = 4NaOH + O2↑
C.2F2 + 2H2O = 4HF + O2 ↑
D.2Na + 2H2O = 2NaOH + H2↑
查看答案和解析>>
科目:高中化学 来源:2015届江西南昌三中高三11月份月考化学试卷(解析版) 题型:选择题
(8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
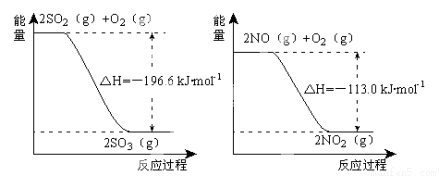
则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:

①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
气体 | SO2 | O2 | SO3 |
物质的量(mol) | 1.6 | 1.8 | 0.4 |
10min内该反应的反应速率v(O2)= ;该反应达到化学平衡状态的标志是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
(3)用NH3催化还原NOx可以消除氮氧化物的污染。
①写出氨气消除NO污染的化学方程式 ___________________________ ;
②若还原产物比氧化产物多0.5mol,则反应转移电子数为 ________ 。
查看答案和解析>>
科目:高中化学 来源:2015届江西南昌三中高三11月份月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑
B.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O
C.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+
D.向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:选择题
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为
A.0. 15mol/L B.0.3mol/L C.0.5mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:选择题
下列各组离子一定能大量共存的是( )
A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:①SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) △H=a kJ·mol-1
2SOCl2 (g) △H=a kJ·mol-1
②SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2 (g)
(g) SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
SO2Cl2(g) △H = kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K = 。
(2)磺酰氯可与白磷发生反应为:P4 + 10 SO2Cl2 = 4PCl5 + 10SO2↑,若生成1molSO2,则转移电子的物质的量为 mol。
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图-1。

①若用浓盐酸与二氧化锰为原料制取Cl2,其 反应的化学方程式为 。
反应的化学方程式为 。
②有关图-1所示的装置说法正确的是 (不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U 形管中盛放的可能是碱石灰
形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为 。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图-2所示,已知电池反应为:2Li + SO2Cl2 = 2LiCl + SO2↑;则电池工作时,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:Na+、NH4+、MnO4-、SO32-
B.pH=14的溶液中:Mg2+、K+、Cl-、HCO3-
C.0.1mol·L-1 NH4I溶液中:Ca2+、Fe3+、SO42-、Br-
D.0.1mol·L-1 CuCl2溶液中:Mg2+、Al3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸溶液中,A为负极;②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀硫酸溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是
A.A>B>C>D>E B.A>C>D>B>E
C.C>A>B>D>E D.B>D>C>A>E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com