
| A. | 能使淀粉-KI试纸显蓝色的溶液中:K+、H+、SO42-、I- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | 在酸性KMnO4溶液中:Na+、C2H5OH、NH4+、Cl- | |
| D. | 澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
分析 A.能使淀粉-KI试纸显蓝色的溶液,具有氧化性;
B.能溶解CaCO3的溶液,具有酸性;
C.KMnO4可氧化乙醇;
D.该组离子之间不反应.
解答 解:A.能使淀粉-KI试纸显蓝色的溶液,具有氧化性,不能存在还原性离子I-,故A不选;
B.能溶解CaCO3的溶液,具有酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故B不选;
C.KMnO4可氧化乙醇,不能大量共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgCl 沉淀 | B. | 只有AgI 沉淀 | ||
| C. | AgCl、AgI 都沉淀,以AgCl 为主 | D. | AgCl、AgI 都沉淀,以AgI 为主 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
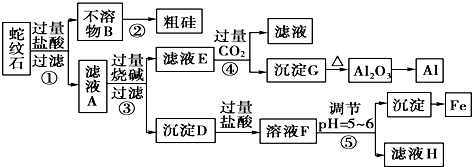
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
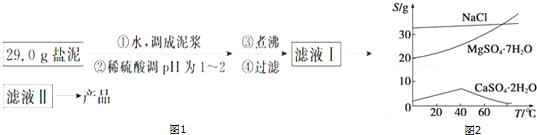
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL氢氧化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com