
已知:2-硝基-1,3-苯二酚是桔黄色固体,易溶于水、溶液呈酸性,沸点为88℃,是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:

 具体实验步骤如下:
具体实验步骤如下:
① 磺化:称取5.5g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60℃~65℃约15min。
② 硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25
±5)℃左右继续搅拌15 min。
③ 蒸馏:将反应混合物移入圆底烧瓶B中,小心加入适量的水稀释,再加入约0.1g尿素,然后用右图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇-水混合剂重结晶。
根据以上知识回答下列问题:
⑴ 实验中设计I、Ⅲ两步的目的是 ▲ 。
⑵ 烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故、又能 ▲ 。
⑶ 步骤②的温度应严格控制不超过30℃,原因是 ▲ 。
⑷ 步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇-水混合剂洗涤。请设计简单的证明2-硝基-1,3-苯二酚已经洗涤干净 ▲ 。
⑸ 本实验最终获得1.0g桔黄色固体,则2-硝基-1,3-苯二酚的产率约为 ▲ 。
科目:高中化学 来源: 题型:
对于反应3S+6KOH 2K2S+K2SO3+3H2O,下列说法正确的是( )
2K2S+K2SO3+3H2O,下列说法正确的是( )
A.S是氧化剂,KOH是还原剂 B.若3mol硫完全反应,则反应中共转移了4mol电子
C.还原剂与氧化剂的质量比是1:2 D.氧化产物和还原产物的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH溶液发生反应。已知加入NaOH溶液的体积(x轴)和生成的沉淀质量(y轴)之间的关系,可用下图表示,则下列图中描述正确的是( )
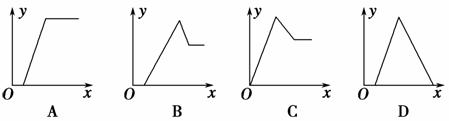
查看答案和解析>>
科目:高中化学 来源: 题型:
以下因果关系成立的是
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH
D.因为Al能与强碱溶液反应,所以Al有一定的非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书正确的是
A.碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
C.用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=Fe2++S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
⑴ 写出QT2+的电子式 ▲ 、基态Z原子的核外电子排布式 ▲ 。
⑵ Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 ▲ 等两种。
⑶ 化合物甲由T、X两元素组成,其晶胞如图1,甲的化学式为 ▲ 。
⑷化合物乙的晶胞如图2,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为 ▲ ,其硬度超过金刚石的原因是 ▲ 。
②乙的晶体中E、Q两种元素原子的杂化方式均为 ▲ 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.焰色反应是化学变化
B.水玻璃、漂白粉、胆矾均为混合物
C.酸性氧化物一定不能与酸起反应
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列叙述正确的是
A.从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
B.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 可用于文物年代的鉴定,
可用于文物年代的鉴定, 与
与 互为同素异形体
互为同素异形体
D.淀粉、油脂和蛋白质都是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
(1)a点时,v(正) ▲ v(逆)(填“<”、“>”或“=”),X线、Y线中代表N2O4的是 ▲ ;
(2)反应在第10 min达到平衡,则前10 min内用NO2表示的化学反应速率v(NO2)= ▲ mol·L-1·min-1。该温度下,反应的平衡常数K= ▲ (可用分数表示);
(3)在第25分钟,进行的操作是 ▲ ;
(4)a、b、c、d四点对应的时刻,NO2物质的量浓度由小到大的顺序是 ▲ ,再次平衡时的d点NO2的体积分数比b点时 ▲ (填“大”、“小”或“相等”);
(5)假如在第35分钟从容器中移去0.4mol N2O4,并加入适当催化剂使反应在第40分钟达到平衡,请在图⑴中画出从第35分钟以后两种物质的物质的量浓度c随时间t的变化关系,并标注所画线条对应的物质。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com