
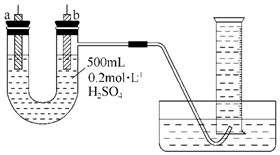
 给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片和500mL 0.2mol•L-1的H2SO4溶液、导线、1 000mL量筒.试用如图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量.分析 锌、铜、硫酸原电池中,电子转移和产生的氢气量之间存在联系;
(1)根据原电池装置的构成条件:闭合回路、电解质溶液、两个电极以及自发氧化还原反应来回答;
(2)活泼失电子的金属锌做负极,发生氧化反应,铜作正极,发生还原反应.
解答 解:(1)根据图示装置,要想求得电子转移的量,需要设计成锌、铜、硫酸原电池,量取金属锌和硫酸反应产生氢气的体积,根据原电池的构成条件,所以首先要用导线把a、b两电极连接起来,
故答案为:用导线把a、b两电极连接起来;
(2)锌、铜、硫酸原电池中,纯锌片是负极,电极反应:Zn-2e-=Zn2+;铜是正极,该极上电极反应为:2H++2e-=H2↑,
故答案为:纯锌片;Zn-2e-=Zn2+;纯铜片;2H++2e-=H2↑.
点评 本题以实验方式为载体考查学生原电池的构成条件和工作原理知识,注意把握原电池的构成条件以及正负极的判断和电极方程式的书写方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 使用二氧化钛作催化剂使水快速分解的同时放出大量热 | |
| B. | 该过程涉及到的反应为氧化还原反应 | |
| C. | 该反应的原理是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2+O2 | |
| D. | 每产生氢气44.8L,转移电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①NH4Cl②NH4Al(SO4)3③NH4HSO3,三种溶液中的c(NH4+):①<②<③ | |
| B. | 20mL0.1mol/L的CH3COONa溶液与10mL0.1mol/L的HCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH4COOH)>c(H+) | |
| C. | 0.1mol/L的NaHCO3溶液与0.1mol/L的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不变 | |
| B. | 通入CO2,溶液pH增大 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用作红色油漆和涂料 | B. | 氧化铝可制耐高温实验材料 | ||
| C. | 明矾可用作净水剂 | D. | 用铝制餐具长时间存放碱性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成NaOH | |
| B. | 足量的MnO2与含4molHCl的浓盐酸加热充分反应,产生的Cl2必为1mol | |
| C. | 含2molHCl的某盐酸滴入足量的碳酸钠溶液中充分反应后,得到CO2气体必为1mol | |
| D. | 过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H2O+CaO═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:3Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com