
用来测定空气成分的方法很多,图1所示的是小明用红磷在空气中燃烧的测定方法。实验过程是:
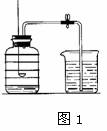
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸
入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
(1)上面的实验同时证明了氮气 有________________的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是_________________(只要求写出一种原因)。
(3)某同学对实验进行反思后,提出了改进方法(如图2所示 ),
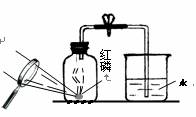
你认为改进后的优点是:________________________________
(4)小刚同学为验证空气中氧气的体积分数,进行实验(如右图所示)。燃烧匙里盛燃着的足量的硫,反应结束,冷却后,打开C夹,水不沿导管进入A瓶。请回答:
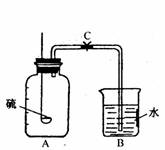
①B容器的名称是_______________。硫在A瓶中燃烧的文字表达式或化学方程式是_______________。
②该实验失败的主要原因是_______________。
③若不改变原装置,要使实验成功,你的改进意见是:_______________。
④若实验成功,可证明空气中氧气的体积分数约为_______________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:物理教研室 题型:022
(1)写出形成酸雨的化学方程式。
(2)空气中的二氧化硫含量过高,会引起人体呼吸障碍,请问二氧化硫主要影响呼吸的哪个过程?
(3)在二氧化硫污染较严重的地区,可种植________植物,以吸收二氧化硫,减少污染。
(4)写出此监测过程中发生的化学反应方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
SO2是引起大气污染的主要有害气体之一,我国大气质量标准中规定大气中SO2的最高浓度限值如下表:大气中SO2三级标准浓度限值
| 浓度限值[mg/(m3空气)] | |||
| 一级标准 | 二级标准 | 三级标准 | |
| 年日平均 | 0.02 | 0.06 | 0.10 |
| 日平均 | 0.05 | 0.15 | 0.25 |
| 任何一次 | 0.15 | 0.50 | 0.70 |
注:“年日平均”为任何一年的平均浓度均值不许超过的限值;“日平均”为任何一日的平均浓度不许超过的限值;“任何一次”为任何一次采样测定不许超过的浓度限值。
据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散,大气中SO2的含量高达3.8mg/(m3空气) ,烟尘达4.5mg/(m3空气),居民健康普遍受到危害,4天之内死亡人数约4000,流经该城市的主要河道也因此而受到污染,引起鱼类死亡。大气中的SO2将直接危害陆生高等植物的____组织,大气中SO2超标最容易影响人的_______系统而患疾病,而河流中鱼类死亡与SO2造成大气污染所形成______有关。
某空气污染监测仪是根据SO2和Br2水的定量反应来测定空气中的SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解池阳极的氧化反应,电解池的阳极室与阴极室是隔开的。当测量某地区空气中SO2的含量时,一天中作了三次取样监测,每次取样的空气(已除尘)都以1.5×10-4m3.min-1的流速进入电解池的阳极室,从电流计显示出每次的电流强度分别为8.56×10-6A、9.25×10-6A 、8.12×10-6A,每次都能够保持电解池中Br2浓度恒定并恰好与二氧化硫完全反应(设空气中不含与溴反应的其它杂质、1个电子电量为1.6×10-19C)。
写出此监测过程中发生反应的化学方程式。计算该地区空气中二氧化硫的含量有没有达到大气质量标准?
当大气中SO2污染较严重时,目前有一种降低其危害的方法是用直升飞机喷撒白垩粉,其化学方程式为___________________。
某火力发电厂所在地有较丰富的碳酸钙矿和菱镁矿,若该发电厂以含硫重油作燃料,请就地取材提出三种化学反应原理与上一小题不同的“脱硫”方法(用化学方程式表示,):
第一种______________;第二种______________; 第三种______________。
某10 6 kW火力发电厂以重油为燃料。以含硫3.5%的重油为燃料,重油使用量为0.18 dm3.kW-1.h-1(重油的密度为0.95g.cm3)。该厂开工率(每年实际运转天数)为80%,对烟道气的脱硫效率为90%。问一年间对烟道气脱硫回收的SO2能生成多少吨石膏(CaSO4·2H2O)?
查看答案和解析>>
科目:高中化学 来源: 题型:
某空气污染监测仪是根据SO2与Br2水的定量反应来测定空气中的SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解槽阳极的氧化反应,电解槽的阳极室与阴极室是隔开的。当测量某地区空气中二氧化硫的含量时,空气(已除尘)以1.5×10-4m3?min-1的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10-11mol?.S-1,此条件下能够保持电解槽中Br2浓度恒定并恰好与二氧化硫完全反应(设空气中不含能与溴反应的其他杂质)。
(1)写出此监测过程中发生反应的化学方程式______________________________________
(2)该地区空气中二氧化硫的含量(单位g/m3空气)为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2+Br2+2H2O![]() 2HBr+H2SO4
2HBr+H2SO4
上述反应的溴来自一个装有酸性(H2SO4)溶液的电解槽阳极上的氧化反应。电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO2含量时,空气(已除尘)以1.5×10-4m3·min-1的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10-11 mol·s-1,此条件下能保持溴浓度恒定并恰好与SO2完全反应(空气中不含能与溴反应的其他杂质)。写出上述材料中监测过程中发生的主要的化学反应方程式及该地区空气中SO2的含量(g·m-3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com