
 某校化学研究性学习小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验,(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)
某校化学研究性学习小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验,(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)| 操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C处产生白色沉淀时,立刻将B装置上提 | |
| Ⅲ.将A中铜丝放入稀硝酸中,给装置A微微加热 | 装置A中产生无色气体 装置E中开始时出现浅红棕色气体 |
| Ⅳ.用F向E中鼓入空气 | 烧瓶E内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C中白色沉淀溶解 |
| ||
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
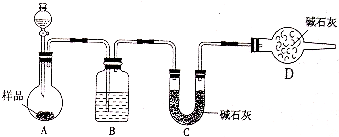
 某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.
某校化学研究性学习小组设计如下实验方案,测定放置己久的小苏打样品中纯碱的质量分数.查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江哈尔滨市第六中学高三上学期期末考试化学试卷 题型:填空题
(14分)某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江哈尔滨市高三上学期期末考试化学试卷 题型:填空题
(14分)某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com