
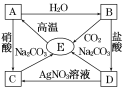
【题目】A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A. 铜B. 碳C. 铁D. 钙
【答案】D
【解析】
根据E高温会生成A,A和水反应生成的B和二氧化碳反应会生成A,可以猜测E是碳酸钙,A为氧化钙,B为氢氧化钙,氢氧化钙和盐酸会生成氯化钙,所以C是氯化钙;氧化钙和硝酸会生成硝酸钙,氯化钙和硝酸银会生成硝酸钙,所以D是硝酸钙,然后将推出的各种物质代入转化关系中验证即可。
E高温会生成A,A和水反应生成的B和二氧化碳反应会生成A,可以猜测E是碳酸钙,A为氧化钙,B为氢氧化钙,氢氧化钙和盐酸会生成氯化钙,所以C是氯化钙;氧化钙和硝酸会生成硝酸钙,氯化钙和硝酸银会生成硝酸钙,所以D是硝酸钙;碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氧化钙和硝酸反应生成硝酸钙和水,氢氧化钙和盐酸反应生成氯化钙和水,氯化钙和硝酸银反应生成硝酸钙和氯化银沉淀,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,氯化钙和碳酸钠反应会生成碳酸钙沉淀和氯化钠,硝酸钙和碳酸钠反应生成碳酸钙沉淀和硝酸钠,推出的各种物质均满足题中的转化关系,所以A是氧化钙,B是氢氧化钙,C是氯化钙,D是硝酸钙,E是碳酸钙,其中所含的相同元素是:钙元素;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾的化合物广泛存在于自然界中。回答下列问题:
(l)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(2)钾的焰色反应为_____色,发生焰色反应的原因是__________________________________。
(3)叠氮化钾(KN3)晶体中,含有的共价键类型有_____________,N3-的空间构型为__________。
(4)CO能与金属K和Mn形成配合物K[Mn(CO)5],Mn元素基态原子的价电子排布式为______________。
(5)原子坐标参数可表示晶饱内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(l,0,0),则C原子的坐标参数为_____________。

(6)钾晶体的晶胞参数为a pm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为____________pm,晶体钾的密度计算式是_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知存在离子反应3S+6OH-=2S2-+SO32-+3H2O,关于该反应的说法正确的是
A. 该反应属于复分解反应
B. 该反应氢氧根离子作氧化剂
C. 该反应中氧化剂与还原剂的质量为2∶1
D. 每生成2个S2-反应转移的电子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.按要求完成下列问题:
(1)甲基的电子式__________;
(2) ![]() 含有的官能团的名称为__________;
含有的官能团的名称为__________;
II.某有机物的结构简式为 ![]() ,据此填写下列的空。
,据此填写下列的空。
(1)该物质苯环上一氯代物有__________种;
(2)lmol该物质和溴水混合,消耗Br2的物质的量为__________mol;
(3)lmol该物质和H2加成需H2__________mol。
III.![]() 与一定量的Br2发生加成反应,生成的产物可能是__________。
与一定量的Br2发生加成反应,生成的产物可能是__________。
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有共价键的化合物可能是共价化合物
B.在共价化合物中可能存在离子键
C.含有离子键的化合物中一定是没有共价键
D.难失电子的原子,获得电子的能力一定强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”,设制一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是_______,电解质溶液是_____________;
②正极的反应式为_____________________.
③若导线上转移电子1mol,则生成银___________克.
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
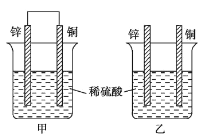
①在相同时间内,两烧杯中产生气泡的速度:甲____________乙(填“>”、“<“或“=” ).
②请写出图中构成原电池的负极电极反应式_______________. 电池工作时,溶液中SO42-向______极(填正、负)移动,电池工作完成后,溶液中SO42-浓度_________(填增大或减小或不变).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com