
| A、硅酸胶体通常带正电 |
| B、直径为1nm---100nm的微粒是胶体 |
| C、在标准状况下,1mol苯的体积约是22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH-;用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3(胶体)+3H+;明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl;制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O2与18O2互为同素异形体 |
| B、16O与18O是氧元素的两种核素 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、16O与18O核外电子排布方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(Fe)=0.05 mol/(L?min) |
| B、v(H2SO4)=0.1 mol/(L?min) |
| C、v(H2SO4)=0.5 mol/(L?min) |
| D、v(FeSO4)=0.1 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol任何物质的体积约为22.4L |
| B、非标准状况下,1mol任何气体的体积不可能为22.4L |
| C、1mol氖气和1mol氧气体积相同 |
| D、标准状况下,1mol氧气和氮气(任何比混合)的混合气的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用丁达尔现象区别 |
| B、加入硫酸镁溶液前者会浑浊而后者无明显现象 |
| C、可用渗析的方法分离 |
| D、可用过滤的方法分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
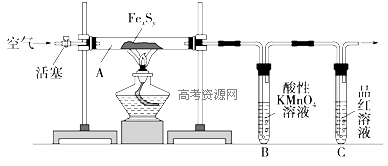
| 滴定次数 | 待测溶液 体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
- 4 |
2- 4 |
- 4 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com