
【题目】回答下列问题
(1)现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3 . (i)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | ⑧⑨ |
(ii)上述物质中属于非电解质的有;上述物质中能与盐酸反应的电解质有(填序号).
(2)(i)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是 , 还原产物是 , 氧化产物与还原产物的质量比是 . (ii)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2 , 转移的电子的物质的量为mol.
【答案】
(1)③④;⑦;④;③⑥⑩
(2)KClO3;HCl;5:1;0.4
【解析】解:(1.)(i)根据物质的元素组成,可以将物质分为纯净物和混合物,纯净物中,根据组成元素的种类可以将物质分为单质和化合物,只有一种元素组成的纯净物是单质,如氧气、铁,根据化合物的性质,可以将化合物分为酸、碱、盐、氧化物,如氧化钙、二氧化碳属于氧化物,根据混合物分散质微粒直径的大小,可以将混合物分为溶液(如硫酸钠溶液、稀硝酸)浊液和胶体(如红褐色的氢氧化铁液体)三种,化合物在水溶液或是熔融态下是否导电,可以将化合物分为电解质和非电解质,如CaO、H2SO4、Ba(OH)2、Cu2(OH)2CO3属于电解质,所以答案是:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ③④ | ⑦ |
(ii)在水溶液中和熔融状态下均不能导电的化合物是非电解质,非电解质包括蔗糖、酒精、非金属氧化物、NH3等,故为非电解质的是④; 电解质是在水溶液中或熔融状态下均不能导电的化合物,故是电解质的是③⑤⑥⑩,其中能和盐酸反应的是③⑥⑩,
所以答案是:④;③⑥⑩;
(2.)(i)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,KClO3为氧化剂,HCl为还原剂,当有3mol Cl2生成时,转移5mol电子,当有1mol Cl2生成时,氧化产物与还原产物的质量之比为 ![]() mol:
mol: ![]() mol=5:1,
mol=5:1,
所以答案是:KClO3;HCl;5:1;(ii)氧化还原反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,失电子的元素氯元素,化合价升高,得电子的元素锰元素,化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=2mol,所以每生成标准状况下4.48LCl2 , 转移的电子的物质的量为 ![]() ×2=0.4mol,
×2=0.4mol,
所以答案是:0.4.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 光导纤维的主要成分是SiO2
B. 玻璃和陶瓷都属于传统硅酸盐材料
C. 明矾和漂白粉均可用于自来水的杀菌、消毒
D. 大量排放SO2会引起酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.40 mol A气体和0.20 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
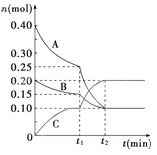
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________________;反应在t2时达到平衡,其化学方程式为_____________________________________。
(2)该反应t2时刻反应化学平衡常数为K=________________________。
(3)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常教的值,下列列说法正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应,产物的分子数为1.5NA
B. 14g乙烯和丙烯混合气体中含有C-H共价键的数目为2NA
C. 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子教为3NA
D. 100mL1mol/LKClO溶液中,阴离子的教目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌.酸性KMnO4溶液与NaNO2的反应方程式是:MnO4﹣+NO2﹣+K→Mn2++NO3﹣+H2O.下列叙述中正确的是( )
A.该反应中NO2﹣被还原
B.反应过程中溶液的pH减小
C.生成1 mol NaNO3需消耗0.4 mol KMnO4
D.K中的粒子是OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0mol/L的HX溶液、HY溶液,分别加水稀释.稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX是强酸,溶液每稀释10倍.pH始终增大l
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a 点大于b 点
D. 消耗同浓度的NaOH溶液体积:a 点大于b 点
查看答案和解析>>
科目:高中化学 来源: 题型:
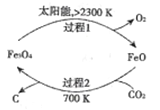
【题目】二氧化碳的回收利用是环保领域研究热点。
(l)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示,总反应的化学方程式为_________。
(2)工业上可用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和液态水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为___________。
(3)如利用CO2和CH4重整可制合成气(主要成分为CO、H2), 其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量均为1mol的CH4和CO2,在一定条件下发生反应。CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:
2CO(g)+2H2(g)。在密闭容器中通入物质的量均为1mol的CH4和CO2,在一定条件下发生反应。CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示:
①压强:P1_____P2(填“>”、“=”或“<”,下同) , y点:V正_______V逆。
②已知气体分压(P分)=气体总压(P总)×气体的体积分数。用气体分压代替平衡浓度可以得到平衡常数KP,求X点对应温度下反应的平衡常数KP=________。

(4)Na2CO3溶液也通常用来捕获CO2,发生如下反应:CO32-+CO2+H2O![]() 2HCO3-,用0.12mol/LNa2CO3溶液若吸收CO2一段时间后,溶液的pH=7,溶液中c(HCO3-)/c(CO32-)=10,则溶液中的c(CO32-) =__________。
2HCO3-,用0.12mol/LNa2CO3溶液若吸收CO2一段时间后,溶液的pH=7,溶液中c(HCO3-)/c(CO32-)=10,则溶液中的c(CO32-) =__________。
(5)甲醇燃料电池(简称DMFC)可作为常规能源的替代品而备受关注。DMFC的工作原理如图所示:
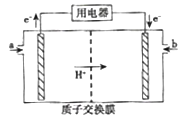
①加入a物质的电极是电池的______(填“正”或“负”)极,其电极反应式为_______。
②常温下以该装置作电源,用情性电极电解NaCl和CuSO4的混合溶液,当电路中通过0.4 mol 电子的电量时,两电极均得到0.14mol的气体。若电解后溶液体积为40L,则电解后溶液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 在豆浆中加入少量的石膏,能使豆浆凝结为豆腐
B. 用灼烧的方法可以鉴别毛织物和棉织物
C. 温度越高,酶的催化活性越强
D. 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com