
| A、14 | B、12.7 |
| C、12 | D、10 |
| KW |
| C(H+) |
| 10-14 |
| 0.01mol/L |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4L H2含有的原子数为NA |
| B、等质量的O2和O3中所含的氧原子数相等 |
| C、常温常压下,14g N2含有电子数为7NA |
| D、28g CO与22.4L CO2所含的碳原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
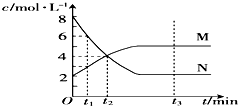 在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )| A、该反应的化学方程式为2N?M |
| B、t1时,M的浓度是N浓度的2倍 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t2时,正、逆反应速率相等,化学反应达到了平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08mol?L-1?min-1 |
| B、若0~5min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中充入1mol He,此时v正>v逆 |
| D、200℃时,平衡后再充入2mol C,则达到平衡时,C的体积分数等于0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、棕红色NO2加压后颜色先变深后变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请按以下要求,回答下列相应问题:
请按以下要求,回答下列相应问题:| 序号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解于酸的时间/s |
| 1 | 2 | 薄片 | 5 | 400 |
| 2 | 2 | 颗粒 | 5 | 500 |
| 3 | 2 | 薄片 | 15 | 200 |
| 4 | 2 | 薄片 | 25 | 100 |
| 5 | 2 | 薄片 | 35 | 50 |
| 6 | 2 | 颗粒 | 15 | t1 |
| 7 | 2 | 粉末 | 15 | t2 |
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com