
【题目】I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
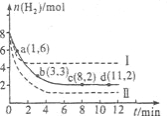
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。计算其化学平衡常数K=
(2)下列时间段平均反应速率最大的是
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)锰酸锂、钛酸锂都是绿色环保新型能源材料,可以用MnO2为原料制取锰酸锂。
①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,则阳极的电极反应式为 。
②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,正极的电极反应式为 。
【答案】(1)大于 K = 0.5L2/mol2 (2)A (3) 升温 增大压强或增大CO2 浓度
(4)①Mn2++2H2O﹣2e﹣=MnO2+4H+ ②MnO2+H2O+e﹣=MnO(OH)+OH﹣
【解析】(1)a点反应没有达到平衡,向正反应方向进行,正反应速率大于逆反应速率,根据三段式:
CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始 3mol/L 4mol/L 0 0
变化1mol/L 3mol/L 1mol/L 1mol/L
平衡 2mol/L 1mol/L 1mol/L 1mol/L
K=1×1/(2×13)=0.5L2/mol2;
(2) 反应开始时,反应物浓度最大,故开始时速率最大,选A;
(3)从图中可判断,改变实验条件后,达到平衡所用时间短,即反应速率加快人,平衡时H2的量减少,平衡正向移动,可以增大压强或增大CO2 浓度;
⑷①以石墨为电极,电解酸化的MnSO4溶液可制备MnO2,阳极发生氧化反应,在阳极产生了MnO2,根据化合价、电荷守恒、原子守恒,阳极的电极反应式为:Mn2++2H2O﹣2e﹣=MnO2+4H+;②MnO2是碱性锌锰电池的正极材料.碱性锌锰电池放电时,锌是负极,MnO2是正极,正极的电极反应式为:MnO2+H2O+e﹣=MnO(OH)+OH﹣。


科目:高中化学 来源: 题型:
【题目】根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为
A. SO2 B. Na2SO4 C. S D. Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() 的原子可发生下列放射性变化:
的原子可发生下列放射性变化: ![]() →
→![]() +
+ ![]()
A. X的氢氧化物是一种强碱 B. X元素位于第六周期
C. X的碳酸盐难溶于水 D. X的最高化台价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列反应合成甲醇CO(g)+2H2(g)CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 3.041 | 1.000 | 0.120 |
由表中数据判断△H 0(填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300℃时,在体积为2.0L的密闭容器中通入2mol CO和4mol H2,经过20s 达到平衡状态,
①计算20s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2和1mol CH3OH气体,平衡移动情况是
(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1277.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H3=﹣44kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
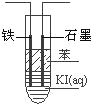
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学平衡时,下列说法不正确的是
A. 正反应速率等于逆反应速率 B. 反应物和生成物浓度不再发生变化
C. 反应体系中混合物的组成保持不变 D. 正、逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮食是保证我们身体健康的基本需求,下列关于饮食的说法正确的是
A. 鸡蛋含有丰富的蛋白质,人类需要的蛋白质都可以由鸡蛋提供,多吃有益
B. 水果、蔬菜含有丰富的维生素,有人为了减肥,每天只吃水果蔬菜即可
C. 米饭含有大量的淀粉,成人每天食用量不能超过200g。
D. 要促进身体健康,各种食物必须合理搭配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
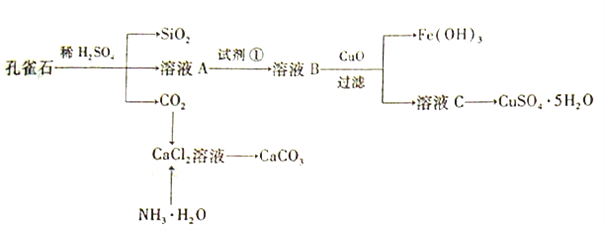
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为____(填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、__________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是______。
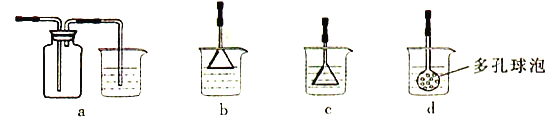
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)___________(填化学式),若实验过程中有氨气逸出,应选用下列______装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应____,直到_____,用KMnO4标准溶液滴定时应选用____滴定管(填“酸式”或“碱式”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com