
某主族元素原子的核外电子排布最外层是第5层,其上有一个电子。下列描述正确的是( )
A.其单质常温下跟水反应不如钠剧烈
B.其原子半径比钾原子半径小
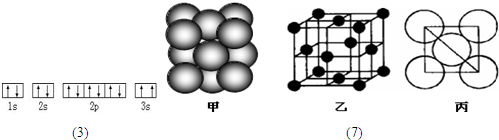
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解
学习元素及其化合物这一部分内容要注意用周期律来统帅,学习了钠、钾及其化合物的性质,只是个别的、零碎的知识,把它们放回周期表,它们就成为碱金属元素的代表。由个别到一般,由个性到共性,再利用共性举一反三,就可以推测其他碱金属元素及其化合物的性质。所以,经常考虑位、构、性的关系,学到的一点知识,就可以成为一串知识,能力就增大了。题设的元素是37号Rb(铷)(解题时无需知道其名称)。从该元素的原子最外层是第5层且只有1个电子,可以确定它应在周期表中ⅠA组(碱金属),并且是第5周期。其性质应该跟熟知的Na、K相比较,而且K比Na的下面,该元素还在更下面。所以由K比Na强的性质,它应更强;K比Na弱的性质,它应该更弱。据此进行逐项判断。 A项,常温下跟水反应,K比Na强,所以不对,不选。B项,原子半径K比Na大,所以不选。C项,Na2CO3、K2CO3都溶于水,应选。D项,NaOH,KOH都是强碱,可使Al(OH)3(两性)溶解,选项说不能,所以不对,也不选。 这里,我们不但借用了Na、K所代表的碱金属及其化合物的共同性质,还借用了K、Na的性质的差异,“类比”“推论”到Rb、K、Na。这是最简捷的方法。
|


科目:高中化学 来源: 题型:阅读理解
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 NH3?H2O+H+
NH3?H2O+H+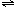 NH3?H2O+H+
NH3?H2O+H+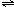 BiOCl+2HCl
BiOCl+2HCl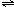 BiOCl+2HCl
BiOCl+2HCl查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.其单质常温下跟水反应不如钠剧烈
B.其原子半径比钾原子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com