
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)
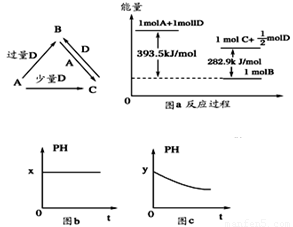
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为_________
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为___________
②反应B+A→C的离子方程式为____________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中x________7(填“﹥”“﹤”“=”)。②若图c符合事实,则其pH变化的原因是_______(用离子方程式表示)
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________
(1)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
(2)? Al(OH)3 Al3++3AlO2-+6H2O=4Al(OH)3↓。
(3) CO2 > ? 2HSO3-+O2=2SO42-+2H+
(4)? ΔH=-110.6 kJ/mol
【解析】
试题分析:(1)金属单质与少量的酸D发生反应得到C,当酸过量时,C与酸继续发生反应得到B,金属单质也可以与过量的酸直接反应得到B。说明A为变价金属,在中学化学中只有Fe,酸D为强氧化性的酸,则为HNO3。B为Fe(NO3)3,C为Fe(NO3)2. 反应C+D→B的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。(2)若A、B为盐,D为强碱,A的水溶液显酸性,符合上述关系的各种物质分别是A为AlCl3,B:NaAlO2;C: Al(OH)3;D:NaOH. ①C的化学式为Al(OH)3. ②反应B+A→C的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化①若图b符合事实,则A:NaOH;B:NaHCO3;C:Na2CO3;D:CO2。NaHCO3是强碱弱酸盐,水解使溶液显碱性,所以pH>7。②若图c符合事实,A:NaOH;B:NaHSO3;C:Na2SO3;D:SO2。则其pH变化的原因是2HSO3-+O2=2SO42-+2H+.由亚硫酸氢盐变为强酸的酸式盐NaHSO4。(4)若A为非金属单质,则符合要求的物质是:A:H2;D:O2;C:H2O,反应方程式为H2+1/2O2 H2O.该反应的反应热为:—393.5+282.5=—110.6KJ/mol。
H2O.该反应的反应热为:—393.5+282.5=—110.6KJ/mol。
考点:考查物质的推断、化学式、离子方程式的书写及反应热的计算的知识。


科目:高中化学 来源: 题型:
 A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).
A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):试回答:
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):试回答:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3 2NH3
2NH3

| 4(m-n) |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4n+m |
| 5 |
| 4m+3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| m-3n |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
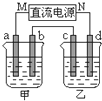 如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )
如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )| A、甲、乙溶液的pH均减小 | B、电极b上生成气体的体积约为2.8L(标准状况下) | C、电极d上发生的反应为:2H2O+2e-?H2↑+2OH- | D、欲使甲中的溶液恢复至原来的浓度,可加入24.5g的Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题:
.甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com