
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.1L 1mol/L的氯化钠溶液中,所含离子数为NA
B.4g金 属钙变成钙离子时失去的电子数目为0.1NA
属钙变成钙离子时失去的电子数目为0.1NA
C.在常温常压下,11.2L N2含有的分子数为0.5NA
D.5.6 g铁与足量盐酸反应转移的电子数为0.2NA
科目:高中化学 来源:2016-2017学年西藏山南二中高二上学期期中化学试卷(解析版) 题型:选择题
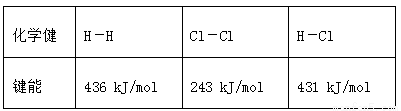
通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列 热化学方程式不正确的是( )
热化学方程式不正确的是( )
A.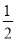 H2(g)+
H2(g)+ 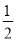 Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+18 3 kJ·mol-1
3 kJ·mol-1
D.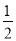 H2(g)+
H2(g)+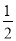 Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高一上期中化学卷(解析版) 题型:实验题
实验室在加热条件下H2还原CuO所得的红色固体可能是Cu与Cu2O的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。现有8g CuO被H2还原后,得到红色固体6.8g。
(1)写出H2还原CuO生成Cu2O的化学方程式 ;
(2)6.8 g上述混合物中含Cu与Cu2O的物质的量之比是 ;
(3)若将6.8 g上述混合物与足量的稀硫酸充分反应后过滤,可得到固 体 g
体 g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高一上期中化学卷(解析版) 题型:选择题
下列变化需加入氧化剂才能实现的是( )
A.SO2→SO32- B.MnO4- →Mn2+ C.HCl→Cl2 D.H2SO4→H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高一上期中化学卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.在同温同压下,SO2与O2的密度之比为1︰2
B.氧化还原反应的本质是有化合价的升降
C.AgNO3溶液在电流作用下电离出 Ag+与NO3- 而导电
Ag+与NO3- 而导电
D.液态HCl不导电,但HCl属于电解质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省蕲春县高一上学期期中化学试卷(解析版) 题型:填空题
(1)现有34 g某气体,其摩尔质量为17 g·mol-1.则:
①该气体物质的量为________mol;
②该气体若为双原子分子,则所含原子数________NA;
③该气体在标准状况下的体积是________L;
(2)将标准状况下11.2L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为________;
(3)0.3molCO和 CO2混合气体,质量为10.8克,CO和CO2的物质的量之比 .
CO2混合气体,质量为10.8克,CO和CO2的物质的量之比 .
(4)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
还原剂是________,还原产物是________;
氧化剂与氧化产物的物质的量比是________;
当有2molHNO3参加反应时,被氧化的物质是 g.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省蕲春县高二上学期期中化学试卷(解析版) 题型:填空题
T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X) /mol | n(Y) /mol | n(Z) /mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | 0.20 |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式_________________
(2)反应进行到10min,X的转化率为___________,0~5min内Y的平均反应速率为___________
(3)计算T℃时该反应的平衡常数K=____________
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正 v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如下图A、B所示:
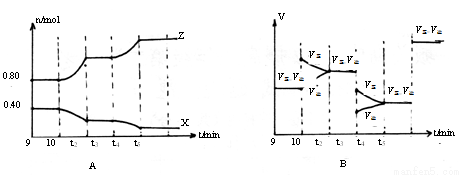
10min时改变的反应条件是_______________
②t3时刻改变的反应条件是_______________
③t5时刻改变的反应条件是 ,理由是___________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高二上学期期中化学试卷(解析版) 题型:填空题
在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)mol | 0.200 | c1 | 0.10 | c3 | a | b |
c(NO2)mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
试填空:(1)该反应的化学方程式为_______________,
(2)达到平衡时四氧化二氮的转化率为__________________。
(3)20s时四氧化二氮的浓度c1=_____________mol·L-1,
(4)在0~20s时间段内,二氧化氮的平均反应速率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com