
 ,能用该结构简式表示的X的同分异构体共有(不考虑立体异构)( )
,能用该结构简式表示的X的同分异构体共有(不考虑立体异构)( )| A. | 12种 | B. | 16种 | C. | 20种 | D. | 24种 |
分析 先找出丁基的同分异构体,再找出-C3H6Cl的同分异构体,然后找出有机物的种类数.
解答 解:丁烷有2种结构:CH3CH2CH2CH3、CH3CH(CH3)CH3,分子中分别含有2种、2种H原子,故丁基(-C4H9)共有4种;-C3H6Cl的碳链为C-C-C,氯原子分别在1号、2号、3号碳上(与1号重复),共有2种,1个氯在1号碳上,剩下的苯环在1号、2号或者3号碳,有3种结构;1个氯在2号碳上,剩下的一个苯环在2号、3号碳上,有2种结构,总共5种,所以该有机物共有4×5=20种;
故选C.
点评 本题考查同分异构体的书写,难度不大,注意二氯代物的书写可以采用定一议二法解题以及组合法的使用.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在人体内水解的最终产物是葡萄糖 | |
| B. | 蔬菜水果属于碱性食物,对人体健康有益 | |
| C. | 为了防止蛋白质发生盐析,疫苗等生物制剂要冷藏 | |
| D. | 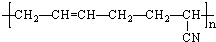 由CH2=CH2与CH2=CH-CN加聚而成 由CH2=CH2与CH2=CH-CN加聚而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
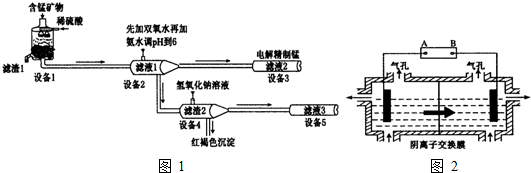
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
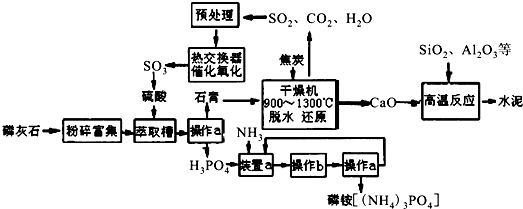
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
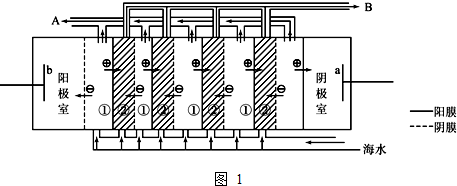

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:Na+、Mg2+、ClO-、SO42- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl- | |
| D. | 由水电离产生的c(OH-)=1×10-10 mol•L-1的溶液中:Ba2+、K+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
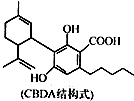
| A. | 1个CBDA分子中含有2个手性碳原子 | |
| B. | 1 mol CBDA 最多可与2molBr2反应 | |
| C. | 1 mol CBDA最多可与3 mol NaHCO3反应 | |
| D. | 1 mol CBDA最多可与2mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com