(2011?湖南二模)[化学一选修化学与技术]
纯碱(Na
2CO
3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30?35
0C
(2)搅拌下分批加入研细的NH
4HCO
3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO
3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转人蒸发皿中灼烧得Na
2CO
3固体
问题:①反应将温度需控制在30?35曟,通常采取的加热方法为
水浴加热
水浴加热
;控制该温度的原因是
温度过高时碳酸氢铵受热分解剧烈,温度太低又减慢了化学反应的速率
温度过高时碳酸氢铵受热分解剧烈,温度太低又减慢了化学反应的速率
.
②静置后只析出NaHCO
3晶体的原因是
相同温度下,碳酸氢钠的溶解度小
相同温度下,碳酸氢钠的溶解度小
.
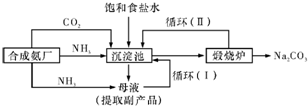
【工业制备纯碱】
③沉淀池中反应的离子方程式为
NH3+CO2+H2O+Na++Cl-=NH4++Cl-+NaHCO3↓
NH3+CO2+H2O+Na++Cl-=NH4++Cl-+NaHCO3↓
;
④循环(I)、循环(II)中物质的化学式分别为
NaCl、CO2
NaCl、CO2
.两种制备纯碱的方法中,共同涉及的化学反应方程式为
NH
3+CO
2+H
2O+NaCl=NH
4Cl+NaHCO
3↓,
2NaHCO
3 Na
2CO
3+H
2O+CO
2↑
NH
3+CO
2+H
2O+NaCl=NH
4Cl+NaHCO
3↓,
2NaHCO
3 Na
2CO
3+H
2O+CO
2↑
.

 (2011?湖南二模)[化学一选修化学与技术]
(2011?湖南二模)[化学一选修化学与技术]



 (2011?湖南二模)2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )
(2011?湖南二模)2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )