(2011?崇明县一模)工业制硝酸的主要反应是:4NH
3(g)+5O
2(g)?4NO(g)+6H
2O(g)+Q;Q>0
(1)该反应的平衡常数表达式为
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
| c4(NO)c6(H2O) |
| c4(NH3)c5(O2) |
,升高温度K值
减小
减小
(填“增大”、“减小”或“不变”)
(2)若反应起始的物质的量相同,下列关系图错误的是
AC
AC
(填序号)

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.7 |
1.475 |
0.1 |
①反应在第2min到第4min时,O
2 的平均反应速率为
0.1875
0.1875
mol/(L.min)
②反应在第2min时改变了条件,改变的条件可能是
AB
AB
(填序号)
A、使用催化剂 B、升高温度
C、减小压强 D、增加O
2 的浓度
③在第6min时,改变了反应的条件,该平衡向
左
左
移动(填“左”或“右”).




 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案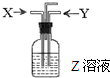 (2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )
(2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )